HỘI CHỨNG CHUYỂN HÓA VÀ COVID-19
PGS. TS. Nguyễn Thị Phi Nga, TS. BS. Nguyễn Thế Thành, BS CKI. Nguyễn Thị Thảo
1. Đại cương hội chứng chuyển hóa
1.1. Khái niệm hội chứng chuyển hóa
Hội chứng chuyển hóa (HCCH) là một nhóm các yếu tố nguy cơ xơ vữa động mạch bao gồm béo phì trung tâm, tăng glucose máu, tăng huyết áp và rối loạn lipid máu.
Tuỳ theo lợi ích của quần thể nghiên cứu và sử dụng mà ngưỡng tiêu chí của các thành tố trong hội chứng chuyển hoá có khác nhau. Cho đến nay, các tổ chức đưa ra định nghĩa về hội chứng chuyển hóa bao gồm: Tổ chức Y tế Thế giới (WHO), Hiệp hội Châu Âu Nghiên cứu về kháng insulin (EGIR), Liên đoàn tiểu đường quốc tế (IDF), và Chương trình giáo dục Cholesterol của Hoa Kỳdành cho người trưởng thành (NCEP-ATP III).
1.2. Dịch tễ học hội chứng chuyển hóa
Tỷ lệ mắc HCCH thay đổi từ 10% đến 84%, tùy thuộc vào giới tính, tuổi tác, chủng tộc, và dân tộc. Tần xuất của hội chứng chuyển hóa đã và đang gia tăng khắp Châu Âu và Bắc Mỹ song song với sự gia tăng ở người thừa cân, béo phì và đái tháo đường. Ở Đông Nam Á, mặc dù chỉ số BMI thường thấp hơn ở phương tây nhưng tần suất của HCCH cũng đang tăng đáng kể. Tỉ lệ mắc HCCH ở người châu Á hiện nay khoảng 31%, ở châu Âu khoảng 30-80%.
1.3. Cơ chế bệnh sinh của hội chứng chuyển hóa
Cho đến nay cơ chế bệnh sinh rõ ràng của HCCH vẫn còn đang được các nghiên cứu tiếp tục làm sáng tỏ. Tuy nhiên, có một số yếu tố tham gia và quá sinh bệnh sinh của HCCH được nhiều nghiên cứu thừa nhận. HCCH là tình trạng viêm mạn tính, hậu quả của sự tương tác phức tạp giữa kháng insulin, béo phì và tích tụ mỡ nội tạng, rối loạn lipid máu, rối loạn chức năng nội mạc, nhạy cảm gen, tăng huyết áp, tăng đông, và stress mãn tính là một số yếu tố cấu thành của hội chứng.
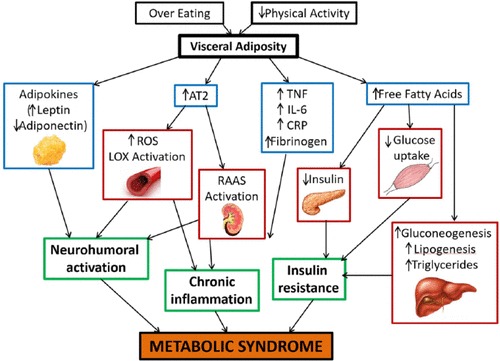
Hình 1. Cơ chế bệnh sinh của hội chứng chuyển hóa
* Kháng insulin:
Kháng insulin có vai trò trung tâm trong sinh bệnh học của tăng glucose máu cũng như hội chứng chuyển hóa. Trong tình trạng kháng insulin, tế bào beta tuyến tụy tiết ra nhiều insulin hơn để khắc phục tình trạng tăng glucose máu. Tăng insulin máu có thể bù đắp cho tình trạng suy giảm một số hoạt động sinh học của insulin để duy trì lượng glucose bình thường trong máu nhưng nó lại gây ra sự hoạt động insulin quá mức ở một số mô nhạy cảm thông thường. Sự tác động mạnh của một số hoạt động insulin cùng với sự đề kháng với các hoạt động khác của insulin dẫn đến các biểu hiện lâm sàng của HCCH. Insulin kích thích thần kinh giao cảm làm tăng huyết áp. Kháng insulin gây nên tình trạng tăng cường thủy phân triglyceride tại tế bào mỡ, giải phóng nhiều acid béo tự do làm tăng sự đề kháng insulin tạo thành vòng xoắn bệnh lý. Đề kháng insulin cũng có thể trực tiếp dẫn đến tổn thương chức năng nội mạc, xơ vữa động mạch. Tăng insulin máu có thể làm tăng sự biểu lộ của phân tử kết dính ICAM-1 (vascular cell adhesion molecular-1), làm tăng sự kết dính đại thực bào vào nội mạc.
* Béo phì:
Mô mỡ không chỉ có chức năng tích trữ năng lượng mà còn là một kho nội tiết sản xuất nhiều loại cytokine. Béo phì gây nên tình trạng giảm cung cấp oxy máu tại tế bào mỡ do sự tăng sinh nhanh chóng cả về kích thước và số lượng tế bào mỡ. Tình trạng thiếu oxy ở tế bào mỡ gây ra hoại tử và xâm nhập đại thực bào vào mô mỡ dẫn đến sản xuất quá mức các chất chuyển hóa có hoạt tính sinh học được gọi là adipocytokine, glycerol, axit béo tự do (FFA), chất trung gian tiền viêm: yếu tố hoại tử khối u-alpha (TNF-α) và interleukin-6 (IL-6), chất ức chế hoạt hóa plasminogen-1 (PAI-1), và protein phản ứng-C (CRP).
Tình trạng FFA cao gây quá tải lipid ở cơ và gan, làm tăng kháng insulin. Trong khi đó tình trạng tuyến tụy tiếp xúc với mức tăng FFA kéo dài dẫn đến suy giảm chức năng tế bào beta. Tăng FFA làm tăng sản xuất fibrinogen và PAI-1.
TNF-α: hoạt động tại chỗ làm giảm nhạy cảm insulin của tế bào mỡ. Bằng chứng cho thấy TNF-α gây chết tế bào mỡ và thúc đẩy sự đề kháng insulin bằng cách ức chế con đường tín hiệu thụ thể insulin. Nồng độ TNF-α huyết tương có tương quan thuận với trọng lượng cơ thể, vòng eo và triglyceride (TG), tương quan nghịch với nồng độ HDL-C.
CRP: Mức CRP tăng cao có liên quan đến vòng eo lớn, kháng insulin, BMI và tăng đường huyết và tăng lên với số lượng các thành phần của HCCH. Đã có chứng minh rằng nồng độ CRP có thể là một chỉ số dự báo độc lập quan trọng của kết cục bất lợi của HCCH. CRP, IL-6 có khả năng ức chế hoạt động của lipoprotein lipase. Nó đã được chứng minh là có tương quan thuận với BMI, insulin máu lúc đói, và tương quan nghịch với nồng độ HDL-C và sự tiến triển thành ĐTĐ typ2.
IL-6: được tiết ra bởi cả mô mỡ và cơ xương, có cả tác dụng gây viêm và chống viêm. Thụ thể IL-6 cũng được biểu lộ trong một số vùng của não, như vùng dưới đồi, tại đó nó kiểm soát sự thèm ăn và tiêu thụ năng lượng. Nó là một cytokin toàn thân, vừa làm suy yếu độ nhạy insulin nhưng cũng là một yếu tố chính quyết định sự sản xuất CRP của gan.
PAI-1: Một chất ức chế serine protease được tiết ra từ tế bào mỡ bụng, tiểu cầu và nội mạc mạch máu. Nó tác động bằng cách ức chế các chất kích hoạt plasminogen mô (tPA) và do đó được coi là một dấu hiệu suy yếu của fibrinolysis và xơ vữa động mạch. Nồng độ PAI-1 trong huyết tương tăng ở những người béo phì và tình trạng viêm nhiễm, do đó, làm tăng nguy cơ huyết khối nội mạch và kết quả bất lợi cho tim mạch.
* Rối loạn lipid máu
Kháng insulin dẫn đến rối loạn lipid máu và bệnh vữa xơ động mạch theo nhiều cách. Trong đó, insulin làm tăng quá trình ly giải phân tử mỡ, dẫn đến tăng nồng độ FFA. Trong gan, FFA đóng vai trò là chất nền để tổng hợp các triglycerid, dẫn đến sản xuất nhiều VLDL hơn. Các triglycerid trong VLDL được chuyển sang HDL bởi protein vận chuyển ester cholesterol (CETP) để đổi lấy este cholesteryl, dẫn đến các hạt VLDL giàu HDL và cholesteryl ester. Hơn nữa, HDL được làm giàu bằng triglycerid là cơ chất tốt hơn cho lipase gan, do đó nó được loại bỏ nhanh chóng. Do đó, trong gan của bệnh nhân kháng insulin, lượng FFA thường cao, tổng hợp và lưu trữ triglycerid được tăng lên, và triglycerid dư thừa được tiết ra dưới dạng VLDL. Phần lớn, người ta tin rằng rối loạn lipid máu liên quan đến kháng insulin là hậu quả trực tiếp của việc tăng tiết VLDL ở gan. Những bất thường này có liên quan chặt chẽ với sự gia tăng stress oxy hóa và rối loạn chức năng nội mô, do đó củng cố bản chất tiền viêm của bệnh xơ vữa động mạch.
* Tăng huyết áp
Tăng huyết áp thực sự thường liên quan đến một số bất thường về chuyển hóa, trong đó béo phì, không dung nạp glucose và rối loạn lipid máu là phổ biến nhất . Các nghiên cứu cho thấy rằng cả tăng glucose máu và tăng insulin máu đều kích hoạt hệ thống angiotensin Renin (RAS) bằng cách tăng biểu hiện của angiotensinogen, Angiotensin II (AT II) và thụ thể AT1, trong sự phối hợp, có thể góp phần vào sự phát triển tăng huyết áp ở bệnh nhân kháng insulin.
1.4. Các nguy cơ do hội chứng chuyển hóa
HCCH tăng nguy cơ mắc bệnh xơ vữa động mạch, bệnh mạch máu ngoại vi, bệnh mạch vành, nhồi máu cơ tim, đột quỵ và bệnh đái tháo đường típ 2, đây là những nguyên nhân hàng đầu gây tử vong và tàn tật trên thế giới hiện nay.
2. Đại cương COVID-19
2.1. Khái niệm COVID-19
COVID-19 (coronavirus disease 2019) gây ra bởi coronavirus mới còn được gọi là SARS-CoV-2. Coronavirus là chủng virus có thành phần protein gai (spike prtein) trên vỏ virus, giúp virus tương tác với thụ thể trên tế bào, theo cơ chế tương tự chìa khóa và ổ khóa, từ đó cho phép virus xâm nhập vào bên trong. Có 7 loại coronavirus, trong đó, một số chủng coronavirus có thể gây cảm lạnh thông thường hoặc nghiêm trọng hơn là Hội chứng Hô hấp Trung Đông (MERS) hoặc Hội chứng Hô hấp cấp tính nặng (SARS). Khi phân tích coronavirus mới, các nhà khoa học nhận thấy coronavirus mới cùng loài với virus gây bệnh SARS vào năm 2003 với độ tương đồng lên đến 94,6% các chuỗi axit amin. Coronavirus mới được phát hiện đầu tiên ở Vũ Hán, tỉnh Hồ Bắc, Trung Quốc vào tháng 12/2019 ký hiệu 2019-nCoV hoặc nCoV gây hội chứng hô hấp cấp tính nặng SARS-CoV-2 hay COVID-19. Hiện tại COVID-19 đã có mặt ở tất cả các nước trên thế giới.
2.2. Sinh lý bệnh COVID-19
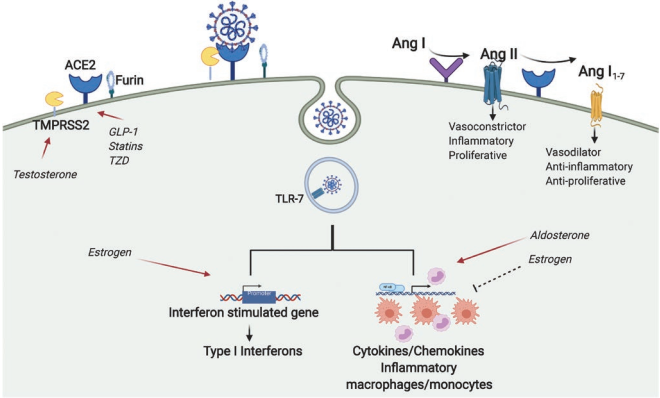
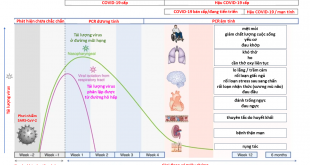
Hình 2: Cơ chế bệnh sinh của COVID-19
* Đường vào của SARS-CoV-2:
SARS-CoV-2 đi vào tế bào cơ thể người bởi sự gắn phần protein gai trên bề mặt(protein S) của SARS-CoV-2 vào enzym ACE2. Protein S này có 2 tiểu phần S1 và S2. S1 chịu trách nhiệm gắn với thụ cảm thể tế bào tại vùng gắn thụ thể (receptor binding domain, RBD) và S2 làm tăng hoà màng của virus sau khi nó được tách ra từ S1 bởi các proteases (hình 2). Sau khi xâm nhập vào trong các tế bào, SARS-CoV-2 sẽ chiếm quyền kiểm soát các hoạt động của tế bào. ACE2 biểu lộ trên nhiều loại tế bào như tế bào biểu mô đường hô hấp,cơ tim, tế bào Leydig và các tế bào ống dẫn tinh, tế bào nội mạc, ống lượn gần, biểu mô dạ dày ruột, tế bào đơn nhân, đại thực bào của phế nang, trong cả đảo tuỵ và tuỵ ngoại tiết. Mỗi khi protein S của SARS-CoV-2 gắn vào enzym ACE2 trên màng tế bào, các proteases của tế bào đích như: transmembrane serine protease2 (TMPRSS2) trong lysosomes sẽ phân cắt protein gai, tạo thuận cho việc virus xâm nhập vào trong tế bào, vì vậy TMPRSS2 và furin có thể tác động đến khả năng lây nhiễm của virus
* Cơ chế tổn thương tế bào nội mạc và tắc mạch do viêm
Sự xâm nhập vào tế bào nội mạc qua trung gian ACE2 của SARS-CoV-2 gây ra viêm và tạo ra môi trường mạch máu tăng đông. ACE2 được coi là một bộ điều chỉnh ngược chống lại ACE vì nó chuyển đổi angiotensin II (Ang-II) thành Ang- (1–7), ngăn cản sự gia tăng Ang-II. SARS-CoV liên kết và làm giảm sự biểu hiện của ACE2 và Ang- (1–7), làm tăng Ang-II, một chất có hoạt động viêm quan trọng, làm tăng sự di cư của bạch cầu đơn nhân cũng như sự xâm nhập của đại thực bào. Những thay đổi này dẫn đến ức chế tiêu sợi huyết và kích hoạt các con đường bổ thể, kết quả là tăng sản xuất thrombin, gây lắng đọng cục máu đông nhỏ. Sự kết hợp giữa tiểu cầu, bạch cầu trung tính và hoạt động của các đại thực bào có vai trò quan trọng trong hiệu quả tiền viêm, đặc trưng bởi sự giải phóng các cytokine và hình thành các bẫy ngoại bào của BC trung tính (nó sẽ bắt vi khuẩn ngoại bào) và lắng đọng các cục máu đông nhỏ. Hơn nữa, tổn thương phổi cấp có thể làm tăng độ nhớt của máu liên quan đến yếu tố cảm ứng khi thiếu oxygen (hypoxia-inducible factor 1, HIF-1), điều này có thể hiệp đồng làm tăng tình trạng tăng đông.
* Cơ chế rối loạn phản ứng miễn dịch ở bệnh nhân COVID-19
Interferon I và II tạo ra phản ứng chống viêm và interferon III làm giảm sự nhân lên của virus, tạo ra hàng rào biểu mô ổn định và ít viêm hơn vì vậy thật dễ hiểu tại sao một phản ứng phù hợp của interferon là cần thiết để chống lại virus và loại bỏ một bệnh nhiễm trùng do virus.
Rối loạn điều hòa phản ứng miễn dịch là một đặc điểm chính của COVID-19, trong đó có sự gia tăng giải phóng cytokine do SARS-CoV-2 ức chế tín hiệu của interferon. Song song với sự giảm tín hiệu của interferon, có sự hoạt hóa rõ ràng của bạch cầu trung tính và đại thực bào là những chất trung gian chính của viêm. Bạch cầu trung tính có một vai trò quan trọng trong cơ chế bệnh sinh của COVID-19, bởi vìSARS-CoV-2 gây ra sự xâm nhập của các tế bào này trong phổi. Sản phẩm hoại tử của tế bào chết cũng như bẫy ngoại bào của bạch cầu trung tính (NET) được tạo ra trong quá trình lây nhiễm kích hoạt các thụ thể nhận dạng mẫu (PRR), làm trầm trọng thêm cơn bão cytokine. Ngoài ra, các bẫy ngoại bào của bạch cầu trung tính có thể góp phần vào rối loạn chức năng nội mạc và huyết khối tĩnh mạch.
Ở bệnh nhân COVID-19, sự tăng của D-dimer, các sản phẩm thoái giáng của fibrin, sự xuất hiện các tắc vi mạch lan rộng gợi ý tình trạng tăng đông với các biểu hiện tăng quá mức fibrin, giảm ly giải fibrin, rối loạn chức năng nội mạch, tăng tính thấm thành mạch.
* Rối loạn điều hòa của hệ thống renin-angiotensin-aldosterone (renin–angiotensin-aldosterone, RAA)
Những thay đổi của hệ thống RAA cũng tham gia vào cơ chế bệnh sinh của COVID-19. Hệ thống RAA gồm một loạt các peptid, peptidaza và các thụ thể điều hòa tham gia vào nhiều quá trình cân bằng nội môi của cơ thể, bao gồm điều chỉnh áp suất, cân bằng nước-điện giải, tính thấm thành mạch và sự phát triển của tổ chức. Mặc dù ACE2 không được tham gia trong hệ thống này, nhưng enzym này là một aminopeptidase màng, được coi là một bộ điều chỉnh ngược chống lại ACE nên ngăn cản sự gia tăng Ang-II trong hệ thống RAA. Việc SARS-CoV liên kết và làm giảm sự biểu hiện của ACE2 có thể có vai trò quan trọng đối với tổn thương phổi. Các dữ liệu cũng gợi ý rằng giảm tỷ lệ ACE/ACE2 có thể mang lại hiệu quả tiềm năng có lợi cho các bệnh nhân tổn thương phổi do COVID-19 vì có nhiều thuốc có thể làm thay đổi tỷ lệ này.
* Cơ chế phân tử của kháng insulin ở bệnh nhân COVID: tích hợp phản ứng với stress (integrated stress response, ISR)
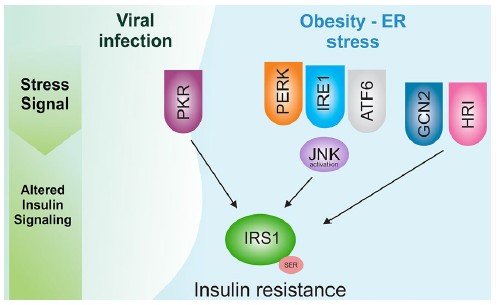
Hình 3: Cơ chế phân tử của kháng insulin ở bệnh nhân COVID
Phản ứng với stress ở cấp độ tế bào đã được tổ chức lại trong một cách hội tụ được gọi là tích hợp phản ứng với stress (integrated stress response, ISR). ISR được gây ra bởi nhiều tình trạng sinh lý và bệnh lý kết hợp như thiếu oxy, nhiễm virus, những stress nội bào. ISR bắt đầu khi các yếu tố gây stress kích hoạt ít nhất một thành viên trong gia đình bốn serine/threonine kinase (như hình 3), sẽ có thể làm giảm con đường tín hiệu của insulin thông qua quá trình phosphoryl hóa serine của insulin, làm giảm tác dụng của insulin. Đặc biệt đối với COVID-19, các đoạn RNA của virus có thể kích hoạt PKR, sẽ tạo ra quá trình phosphoryl hóa serine IRS-1 và hậu quả là kháng insulin. Các nghiên cứu gợi ý rằng kháng insulin luôn đi kèm với ISR. Hơn nữa, cơn bão cytokine và sự gia tăng tín hiệu nội tiết tố như AII và cortisol có thể kích hoạt một số trong bốn kinase và góp phần vào việc đề kháng insulin.
3. Mối liên quan giữa hội chứng chuyển hóa và COVID-19
Trên cơ sở lý thuyết cho thấy giữa cơ chế bệnh sinh của HCCH và COVID-19 có nhiều điểm chung làm người mắc HCCH hoặc mắc các thành phần HCCH dễ mắc COVID-19. Từ khi đại dịch COVID-19 xuất hiện, đã có nhiều nghiên cứu cho thấy mối liên quan giữa hội chứng chuyển hóa(HCCH) và COVID-19 cũng như giữa từng thành phần HCCHvà COVID-19 và đã đưa ra những con số đáng thuyết phục. Mặc dù có sự khác biệt giữa các nghiên cứu, nhưng tất cả đều đồng ý rằng giữa HCCH và COVID-19 có chung đặc điểm chính là kháng insulin. Kháng insulin, dù không có nhiễm trùng, chính nó gây tăng phản ứng viêm hệ thống (như đã đề cập ở trên) và giảm tiềm ẩn phản ứng interferon. Đồng thời với đề kháng insulin, các thành phần khác của HCCH như béo bụng, tăng glucose máu, tăng huyết áp, rối loạn lipid máu, trạng thái tiền đông, tăng độ nhớt của máu có sự hiệp đồng, có thể khuếch đại phản ứng viêm trong cơ chế làm tăng nhạy cảm với nhiễm SARS-CoV-2 và tăng mức độ nặng của bệnh COVID-19.
Nhiễm trùng SARS-CoV-2 làm tăng tình trạng viêm mãn tính cấp độ thấp đang hiện có ở các đối tượng HCCH hoặc có một hoặc nhiều hơn các thành phần của HCCH đều dẫn đến dễ mắc COVID-19 cũng như làm bệnh COVID trầm trọng hơn và làm tăng đáng kể nguy cơ nhập viện và tử vong ở bệnh nhân COVID-19.
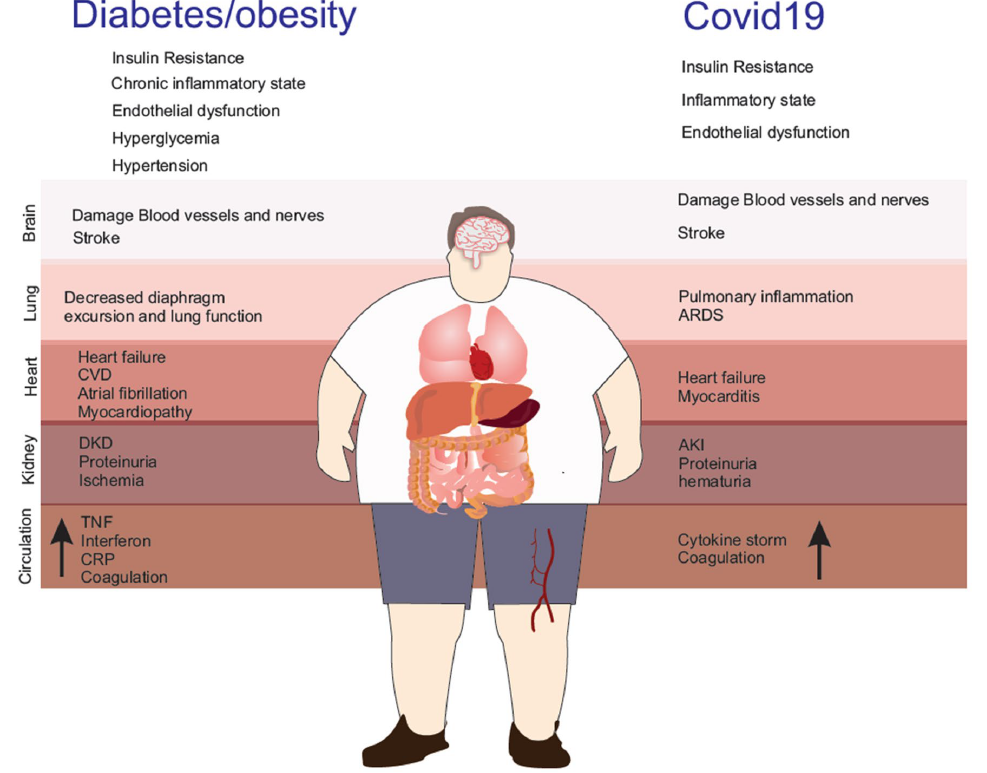
Hình 4: mô tả các biểu hiện lâm sàng và biến chứng của hội chứng kháng insulin ở bệnh nhân COVID song song với ĐTĐ/béo phì
Hình ảnh này mô tả cơ chế viêm của hội chứng kháng insulin và tổn thương hệ thống các cơ quan ở người ĐTĐ và béo phì mắc COVID. Như vậy, tác dụng hiệp đồng giữa COVID-19 và ĐTĐ/béo phì có thể khuếch đại phản ứng viêm góp phần vào làm bệnh COVID nặng hơn ở những bệnh nhân này.
- Mối liên quan giữa hội chứng chuyển hóa và khả năng dễ mắc COVID-19
Ghoneim và cs đã thực hiện nghiên cứu để tìm hiểu mối liên quan giữa HCCH và các thành phần của nó với nguy cơ mắc COVID-19, kết quả cho thấy tỉ lệ cộng dồn của COVID-19 cao hơn ở những bệnh nhân có HCCH (OR, 7.00; 95% CI, 6.11 – 8.01). Nguy cơ mắc COVID-19 (sau khi điều chỉnh) cao hơn ở bệnh nhân tăng huyết áp (OR, 2.53; 95% CI, 2.40-2.68), béo phì (OR, 2.20; 95% CI, 2.10 – 2.32), ĐTĐ (OR, 1.41; 95% CI, 1.33 – 1.48), tăng lipid máu (OR, 1.70; 95% CI, 1.56 – 1.74). Nghiên cứu này đã chỉ ra người có HCCH và/hoặc thành phần của HCCH có khả năng nhiễm SARS-CoV-2 cao hơn.
Scalsky và cs đã phân tích ảnh hưởng của BMI, chỉ số lipid lên nguy cơ xét nghiệm SARS-CoV-2 dương tính trong 9005 người tham gia làm xét nghiệm SARS-CoV-2 từ 16.3 đến 29.6. 2020. Kết quả cho thấy BMI, ĐTĐ típ 2, HbA1c có liên quan đến tăng nguy cơ nhiễm SARS-CoV-2, trong khi HDL-C, apolipoprotein A liên quan đến giảm nguy cơ nhiễm SARS-CoV-2.
Hidekatsu Yanai nghiên cứu mối liên quan giữa nhiễm SARS-CoV-2 và tỉ lệ thừa cân/béo phì (TCBP) và BMI trung bình ở 50 đất nước đứng đầu nhiễm SARS-CoV-2 cho thấy tỉ lệ TCBP và BMI trung bình có tương quan thuận có ý nghĩa thống kê với số bệnh nhân nhiễm SARS-CoV-2, và từ dữ liệu toàn cầu đã chỉ ra liên quan có ý nghĩa giữa TCBP và khả năng mắc COVID-19.
Biểu hiện ACE2 ở các bệnh nhân bệnh phổi tắc nghẽn mạn tính có thừa cân tăng cao hơn so với bệnh nhân không thừa cân đã chỉ ra rằng SARS-CoV-2 có nhiều khả năng đi vào cơ thể người béo hơn. Tăng biểu hiện của ACE2 trong HCCH gây ra bởi béo phì có thể giải thích phần nào mối liên quan có ý nghĩa giữa hội chứng chuyển hóa và khả năng nhạy cảm với nhiễm trùng SARS-CoV-2.
- Mối liên quan giữa hội chứng chuyển hóa và mức độ nặng của COVID-19
Trong thời gian đại dịch, có rất nhiều nghiên cứu đã được thực hiện. Kết quả chung cho thấy tỉ lệ bệnh nhân ĐTĐ, THA, bệnh tim mạch ở bệnh nhân COVID-19 đều cao hơn ở bệnh nhân COVID-19 không nặng. Từ các nghiên cứu cho thấy các thành phần của HCCH cũng như các bệnh tim mạch gây ra bởi HCCH có liên quan với sự phát triển nặng của COVID-19.
Các t/g đã gợi ý rằng biểu hiện cao hơn của ACE2 có thể dẫn đến SARS-CoV-2 vào cơ thể nhiều hơn gây tăng giải phóng cytokin, kết quả làm nặng COVID-19. Tăng biểu hiện của ACE2 ở nhiều nơi cũng có thể làm SARS-CoV-2 phân bố rộng khắp cơ thể dẫn đến COVID-19 nặng.
Những phân tích gộp mới đây đã chỉ ra béo phì, tăng huyết áp, ĐTĐ là những thành phần của HCCH có liên quan mạnh với làm trầm trọng thêm COVID-19. Những rối loạn chức năng nội mạc có từ trước được mô tả ở giai đoạn sớm của xơ vữa động mạch của bệnh nhân HCCH có thể đóng vai trò quan trọng cho phát triển COVID-19.
* Viêm mạch hệ thống nặng do tăng đông:
Nồng độ cao của các protein viêm pha cấp, mức rất cao của D-dimer (marker của tắc mạch) trong khi không có đông máu rải rác lòng mạch đã được mô tả ở bệnh nhân COVID-19 nặng đã gợi ý sự kết hợp giữa viêm và tăng đông ở COVID-19 nặng. Nội mạc không chỉ ảnh hưởng đến 3 thành phần huyết tĩnh: mạch, tiểu cầu, hệ thống ly giải fibrin và tạo cục máu đông của huyết tương mà còn chức năng viêm và sửa chữa tổ chức. Trong điều kiện sinh lý, giãn mạch qua trung gian dòng chảy ngăn cản kết dính tiểu cầu và hình thành cục máu đông. Nội mạc tổn thương do viêm dẫn đến hoạt động đối lập như co mạch, kết dính tiểu cầu bởi yếu tố kích hoạt tiểu cầu (PAF), tăng tạo thrombin, tăng đông máu, lắng đọng fibrin ở thành mạch bởi tăng yếu tố tổ chức (TF), PAI-1. Tăng biểu hiện TNF-α để kích thích xuất hiện của TF, PAF… và giải phóng PAI-1.
Cơ chế tắc mạch do cytokin viêm được chỉ ra trong hình 5. PAF kích hoạt tiểu cầu, TF và VWF liên quan với tăng đông và kết dính tiểu cầu. Hơn nữa, PAI-1 tăng ly giải fibrin. Tổn thương mạch do cytokin viêm dẫn đến tắc mạch.
Phân tích hồi quy đa biến đã chỉ ra tăng tỉ lệ tử vong trong bệnh viện liên quan đến D-dimer > 1µg/mL (OR, 18.42; 95% CI, 2.64 – 128.55; p = 0.0033) ở thời điểm nhập viện. Mức VWF, fibrinogen, D-dimer ở bệnh nhân COVID-19 trong đơn vị chăm sóc tích cực cao hơn bệnh nhân không trong đơn vị chăm sóc tích cực.
* Mối liên quan có ý nghĩa giữa cytokin mô mỡ trong HCCH và mức nặng của COVID-19.
Tích tụ mỡ tạng đóng vai trò quan trọng trong bệnh sinh HCCH bởi sự tăng tiết ILs, TNF-α, angiotensinogen (AGT), leptin, acid béo tự do (FFA) and PAI-1 và bởi giảm tiết adiponectin rất liên quan đến bệnh nhân COVID-19.
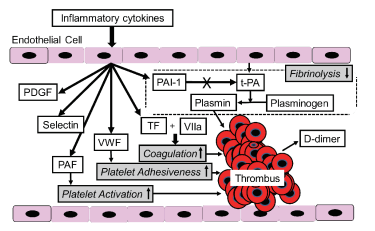
Hình 5: Cơ chế hình thành cục máu đông do các cytokin viêm
– ILs, TNF-α:
+ Trong một phân tích gộp của 23 nghiên cứuliên quan đến 3400 bệnh nhân COVID-19, mức IL-6 thấp hơn ở nhóm bệnh nhẹ nhưng cao hơn có ý nghĩa ở nhóm nặng. Phân tích dưới nhóm, mức IL-6 cao hơn ở bệnh nhân tử vong so với bệnh nhân sống sót.
+ Một phân tích gộp của 50 nghiên cứu ở 7865 bệnh nhân đã chỉ ra sự tăng có ý nghĩa của IL-2, IL-4, IL-6, IL-8, IL-10, TNF-α và interferon-gamma (INF-γ) ở nhóm nặng so với nhóm không nặng.
– PAI-1:
Zuo và cs đã nhận thấy mức tăng cao của t-PA (yếu tố kích hoạt plasminogen tổ chức) và PAI-1 ở những bệnh nhân COVID-19 nhập viện. Cả 2 yếu tố này có tương quan mạnh với bạch cầu trung tính và các dấu ấn hoạt hoá bạch cầu trung tính. Mức cao của t-PA, PAI-1 liên quan đến tình trạng hô hấp xấu.
* ĐTĐ và COVID-19
Ở người lớn tuổi, béo phì và ĐTĐ có tình trạng giảm phản ứng interferon kháng virus sớm, góp phần làm nhạy cảm với COVID-19 nặng. Ngoài ra, nhiễm SARS-CoV-2 cũng làm tăng tình trạng viêm mãn tính tồn tại từ trước dẫn đến bệnh trở nên nghiêm trọng hơn.
Trong bệnh ĐTĐ, những tác động này được tăng cường, bởi vì tăng glucose máu kích hoạt bạch cầu trung tính giải phóng bẫy ngoại bào do đó góp phần vào cơn bão cytokine và nhiễm khuẩn huyết trong COVID-19. Trạng thái viêm này được chứng minh bằng tăng các dấu ấn viêm huyết thanh chẳng hạn như tốc độ lắng hồng cầu, protein phản ứng C, ferritin, fibrinogen, D-dimer và lactate dehydrogenase. Mức cao của các dấu ấn này là dự đoán về bệnh nặng và tỷ lệ tử vong ở bệnh nhân COVID-19.
ĐTĐ là một yếu tố nguy cơ có ý nghĩa với COVID-19 nặng và các biến chứng của bệnh COVID-19. Các dữ liệu gợi ý rằng bệnh nhân ĐTĐ không phải nguy cơ mắc COVID-19. Tuy nhiên, nhiều nghiên cứu đã chỉ ra kết cục xấu hơn khi có mắc ĐTĐ từ trước. Trong một phân tích gộp 44672 bệnh nhân nhiễm SARS-CoV-2 ở Trung Quốc, những bệnh nhân COVID-19 bị ĐTĐ có nguy cơ tử vong cao hơn 4,4 lần bệnh nhân COVID-19 không mắc ĐTĐ. Trong một nghiên cứu đa trung tâm theo dõi dọc ở 7337 bệnh nhân COVID-19 ở Hồ Bắc, Trung Quốc, tỷ lệ bệnh nhân COVID-19 có ĐTĐ tử vong cao hơn không ĐTĐ (7.8% vs 2.7%), tử vong do mọi nguyên nhân ở ngày 28 của bệnh nhân COVID-19 có ĐTĐ cao hơn không có ĐTĐ. Tương tự như vậy, bệnh nhân COVID-19 có ĐTĐ có thể có biến chứng như ARDS, tổn thương phổi cấp, sốc nhiễm khuẩn, có vẻ như tăng glucose máu đã thúc đẩy những nguy cơ này. Nguy cơ tử vong thấp hơn ở phân nhóm glucose máu < 7,5 mmol/L so với phân nhóm kiểm soát glucose máu kém (> 7,6 mmol/L). Cho đến nay, trong 1 nghiên cứu lớn nhất, dữ liệu từ 17,4 triệu người trưởng thành ở Anh được phân tích tìm yếu tố nguy cơ tử vong do COVID-19, sau khi điều chỉnh các biến khác thì thấy ĐTĐ không được kiểm soát là một nguy cơ tử vong độc lập(HR, 2.36; 95% CI, 2.18-2.56). Trong 5700 bệnh nhân COVID-19 ở thành phố New York, Trong số những người đã nhận thông khí can thiệp, bệnh nhân COVID-19 có ĐTĐ tử vong cao hơn những bệnh nhân không có ĐTĐ. Tương tự như vậy, trong một nghiên cứu quan sát đa trung tâm những bệnh nhân ĐTĐ nhập viện vì mắc COVID-19 ở Pháp cho thấy BMI liên quan độc lập với nhu cầu thông khí nhân tạo và/hoặc tử vong. Những nghiên cứu này gợi ý rằng ĐTĐ làm tăng nguy cơ tử vong và biến chứng của COVID-19 và kiểm soát tốt glucose máu liên quan với tỉ lệ tử vong và biến chứng thấp hơn.
* Béo phì và COVID-19
Tăng biểu hiện ACE2 trong hội chứng chuyển hóa có béo phì có thể giải thích một phần về tăng tính nhạy cảm với nhiễm trùng SARS-CoV-2 của hội chứng chuyển hóa.
Cai và cs đã phân tích dữ liệu từ 383 bệnh nhân COVID-19 ở thành phố Thẩm Quyến, đã cho thấybệnh nhân COVID-19 có béo phì sẽ phát triển viêm phổi nặng cao hơn 2,4 lần so với bệnh nhân COVID-19 có cân nặng bình thường. Một nghiên cứu ở Pháp cho thấy bệnh nhân COVID-19 có BMI>35 kg/m2 đã tăng nguy cơ thông khí can thiệp (odds ratio = 7.4; 95% CI, 1.6-33.1). Nghiên cứu 4103 bệnh nhân COVID-19 ở thành phố New York đã chỉ ra béo phì nặng (BMI>40kg/m2) là một yếu tố nguy cơ độc lập mạnh tiên lượng nhập viện. Một nghiên cứu quan sát tiến cứu ở 16749 bệnh nhân COVID-19 nhập viện, béo phì (sau khi đã điều chỉnh tuổi và giới) là yếu tố tăng nguy cơ tử vong (HR = 1.37; 95% CI, 1.16-1.63). Tương tự, một nghiên cứu lớn tại Anh cho thấy béo phì là yếu tố tăng nguy cơ tử vong độc lập (HR = 1,27 khi BMI 30-34,9 kg/m2; 1,56 khi BMI 35-39,9 kg/m2; và 2,27 khi BMI > 40 kg/m2). Các nghiên cứu này gợi ý rằng béo phì là yếu tố nguy cơ có ý nghĩa cho COVID-19 nặng và tử vong.
* Tăng huyết áp (THA) và COVID-19
Những nghiên cứu trước đây đã cho thấy THA hệ thống là nguy cơ kết cục xấu của các bệnh nhân viêm phổi và ARDS. Trong một nghiên cứu ở Trung Quốc đã không thấy liên quan nào giữa THA và COVID. Tuy nhiên, trong một phân tích gộp, Lippi và cs đã thấy rằng THA là tăng 2,5 lần nguy cơ COVID nặng và tử vong. Trong một nghiên cứu lớn ở Anh, khi tính cả yếu tố tuổi, giới thì THA làm tăng nguy cơ tử vong tại bệnh viện (HR = 1.22; 95% CI, 1.15-1.30). Tuy nhiên, sau khi điều chỉnh các yếu tố ảnh hưởng, THA làm tăng nguy cơ này nhẹ.
Tuổi (>60 years; RR = ~2-8 lần), nam giới (RR = ~2), và các thành phần khác của HCCH, mỗi thành phần làm tăng độc lập nguy cơ tử vong (RR = 1,5-2,5). Vì vậy, một người đàn ông da trắng 62 tuổi với BMI = 32 kg/m2 có ĐTĐ típ sẽ có nguy cơ cao hơn 15 lần so với người đàn ông da trắng 50 tuổi không có bệnh đồng mắc. So với người da trắng thì người da đen và châu Á có nguy cơ tử vong vì COVID-19 cao hơn (khoảng 1,7 lần). Những dữ liệu này rõ ràng rằng HCCH là nguy cơ biến chứng COVID-19. Tuy nhiên, cơ chế sinh lý bệnh của những sự tăng này còn chưa rõ ràng và là chủ đề cần được tiếp tục nghiên cứu.
4. Điều trị hội chứng chuyển hóa ở bệnh nhân COVID-19
Hội chứng tim chuyển hoá là yếu tố nguy cơ cho kết cục xấu của COVID-19. Dữ liệu dịch tễ từ 72000 bệnh nhân ở Trung Quốc đã chỉ ra rằng tỉ lệ tử vong do mọi nguyên nhân là 2,3%, nhưng tỉ lệ tử vong cao hơn ở bệnh nhân có bệnh tim mạch (10,5%), ĐTĐ (7,3%), tăng huyết áp (6%). Theo các báo cáo từ Uỷ ban Y tế Quốc gia Trung Quốc, trong số các bệnh nhân chết vì COVID-19, những người không có bất cứ tiền sử bệnh tim nào nhưng có tổn thương cơ tim rất rõ đã nhấn mạnh tầm quan trọng của bảo vệ tim ở bệnh nhân COVID-19. Hơn nữa, di chứng lâu dài của rối loạn chuyển hoá đã được chứng minh ở các bệnh nhân 12 năm sau nhiễm trùng SARS-CoV-1 (2003-2004). Tuy nhiên, trong các thành phần HCCH, ĐTĐ là yếu tố gây rối loạn chuyển hoá cấp, kiểm soát đa yếu tố ở người ĐTĐ có thể đại diện cho điều trị HCCH, làm cải thiện tiên lượng của nhóm đối tượng này nên đã được nhấn mạnh trong các hướng dẫn nhiều hơn các thành tố khác của HCCH.
Bệnh nhân ĐTĐ típ 2 mắc COVID-19 có nguy cơ cao bị viêm phổi nặng, không kiểm soát được tình trạng viêm, tăng đông. Kinh nghiệm của các bác sĩ trên toàn cầu đã cho thấy nhu cầu insulin cao ở bệnh nhân ĐTĐ típ 2 mắc COVID-19 nặng, gợi ý kháng insulin tăng so với bệnh nhân ĐTĐ típ 2 không mắc COVID-19. Vì vậy, điều trị tăng glucose máu sớm và tối ưu là rất quan trọng ở bệnh nhân ĐTĐ. Mặc dù cho đến nay, dữ liệu về điều trị ĐTĐ ở bệnh nhân COVID-19 còn chưa đầy đủ, cách điều trị tăng glucose máu ở bệnh nhân COVID-19 có ĐTĐ có thể theo các khuyến cáo điều trị đã có từ trước, cá thể hoá bệnh nhân dựa trên típ ĐTĐ, sự có mặt của các yếu tố nguy cơ và các bệnh đồng mắc, điều trị ngoại trú hay nội trú.
4.1. Điều trị bệnh nhân ngoại trú
– Khuyến khích rửa tay thường xuyên và giữ khoảng cách theo WHO và các hướng dẫn của CDC.
– Tối đa việc sử dụng khám sức khoẻ từ xa và tăng khả năng tiếp cận của bệnh nhân với người chăm sóc sức khoẻ từ xa dễ dàng.
– Các thuốc uống điều trị ĐTĐ có thể được duy trì nhưng với sự theo dõi chặt.
– Kiểm soát những nguy cơ tiềm ẩn của thuốc uống điều trị ĐTĐ như sau:
+ Metformin: tổn thương thận cấp, nhiễm toan tăng acid lactic máu.
+ Ức chế SGLT-2: mất nước, nhiễm toan tăng ceton-glucose máu bình thường.
+ Đồng vận thụ thể GLP-1: nôn, mất nước, nạp calo bị giảm.
+ Sulfonylureas và meglinides: hạ glucose máu.
– Động viên bệnh nhân uống đủ nước và duy trì đều đặn chế độ dinh dưỡng.
– Bệnh nhân đang dùng insulin nên tiếp tục chế độ đang dùng.
– Glucose máu nên được theo dõi sát (mỗi 4 giờ, bao gồm trước bữa ăn và khi đi ngủ), liều insulin nên được điều chỉnh cho phù hợp.
– Cung cấp dịch vụ hỗ trợ từ xa để giúp tiếp cận thiết bị dụng cụ đánh giá bệnh, kiểm soát glucose máu, và duy trì chế độ dinh dưỡng tối ưu
– Khuyến khích duy trì ít nhất những hoạt động thể lực mức độ trung bình.
– Bệnh nhân ĐTĐ típ 1 phải được tạo điều kiện kiểm tra ceton niệu nếu nhận thấy có thay đổi trong kiểm soát glucose máu của họ.
– Thuốc ức chế men chuyển/ức chế thụ thể nên được được duy trì ở nhà.
– Statins nên được được duy trì ở nhà.
4.2. Điều trị bệnh nhân nội trú
– Thuốc uống điều trị ĐTĐ nên tạm dừng.
– Chế độ tiêm insulin trước bữa ăn và insulin nền theo cân nặng nên được bắt đầu. Theo dõi glucose thường xuyên.
– Những bệnh nhân kháng insulin nặng, đặc biệt những bệnh nhân được đưa đến những đơn vị theo dõi, có thể được điều trị bằng truyền insulin tĩnh mạch.
– Bệnh nhân ĐTĐ típ 1 nên được theo dõi thường xuyên ceton niệu.
– Những bệnh nhân bệnh nặng kèm ĐTĐ típ 2, gan nhiễm mỡ có thể có nguy cơ xuất hiện bão cytokin. Theo dõi sát xét nghiệm chức năng gan, ferritin, IL-6, D-dimer, tốc độ lắng hồng cầu, CRP.
– Những bệnh nhân nhiễm toan ceton do ĐTĐ phải được điều trị theo các phác đồ và các hướng dẫn đã được chấp nhận rộng rãi. Bồi phụ nước, điện giải (hạ kali, magne, phosphate máu) đường tĩnh mạch và truyền insulin nên được thực hiện kịp thời.
– Thuốc ức chế men chuyển/ức chế thụ thể có thể được duy trì khi không có chống chỉ định.
– Statins có thể được duy trì khi không có chống chỉ định.
– Thuốc dự phòng huyết khối tĩnh mạch sâu nên cho dùng ở tất cả các bệnh nhân có hội chứng tim chuyển hoá khi không có chống chỉ định.
5. Kết luận
HCCH và các thành phần của HCCH liên quan có ý nghĩa với khả năng nhiễm SARS-CoV-2 cũng như mức độ nặng của COVID-19. Tăng biểu hiện ACE2, tình trạng tăng đông và rối loạn chức năng nội mạc tồn tại từ trước khi mắc COVID-19 gây ra bởi các cytokin mô mỡ trong HCCH có thể đóng vai trò quan trọng trong COVID-19 nặng. Vì vậy, điều trị cần cá thể hoá bệnh nhân dựa trên sự có mặt của các yếu tố nguy cơ và các bệnh đồng mắc, điều trị ngoại trú hay nhập viện kịp thời khi có nguy cơ chuyển nặng.
TÀI LIỆU THAM KHẢO
- Bansal et al. (2020). “Metabolic Syndrome and COVID 19: EndocrineImmune-Vascular Interactions Shapes Clinical Course”. Endocrinology, October 2020, 161(10):1–15. https://doi.org/10.1210/endocr/bqaa112
- Moazzami B, Chaichian S, Kasaeian A, Djalalinia S, Akhlaghdoust M, Eslami M, et al. (2020). “Metabolic risk factors and risk of Covid-19: A systematic review and meta-analysis”. https://doi.org/10.1371/journal.pone.0243600
- Hidekatsu Yanai (2020). “Metabolic Syndrome and COVID-19”. Cardiol Res;11(6):360-365.
- Kassi et al, Metabolic syndrome: definitions and controversies. BMC Medicine, 2011. 9(48): p. http://www.biomedcentral.com/1741-7015/9/48.
- Santos et al. (2021). “Diabetes, obesity, and insulin resistance in COVID-19: molecular interrelationship and therapeutic implications”. Diabetology & Metabolic Syndrome. https://doi.org/10.1186/s13098-021-00639-2
 Hội Nội tiết & Đái tháo đường Việt Nam Hội Nội tiết & Đái tháo đường Việt Nam
Hội Nội tiết & Đái tháo đường Việt Nam Hội Nội tiết & Đái tháo đường Việt Nam