SARS-CoV-2 VÀ BỆNH ĐÁI THÁO ĐƯỜNG,
MỘT SỐ VẤN ĐỀ THAM GIA VÀO CƠ CHẾ SINH BỆNH
GS Thái Hồng Quang. PGS Nguyễn Thị Hoàn. TS Quách Hữu Trung
Đái tháo đường (ĐTĐ) và kiểm soát glucose máu kém là những yếu tố liên quan độc lập với mức độ nặng, tỷ lệ tử vong của COVID-19 , các biến chứng của ĐTĐ ( bệnh tim mạch, suy tim, bệnh thận mạn tính) làm diễn biến càng nặng và tỷ lệ tử vong do COVID-19 càng tăng. Trong bài này trình bày một số cơ chế bệnh sinh lên quan giữa SARS-CoV-2 và bệnh đái tháo đường, sự phối hợp giữa hai bệnh này làm diễn biến bệnh càng phức tạp, tăng tỷ lệ tỷ lệ tử vong do nhiễm SARS-CoV-2 ở BN ĐTĐ, đặc biệt do tim mạch. (được trình bày trong hình 1). (1)
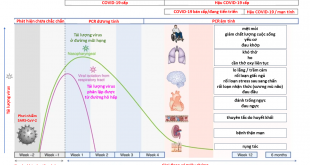
Hình 1. Cơ chế bệnh sinh chủ yếu ở bệnh nhân bị đái tháo đường típ 2 và COVID-19.(những tia chớp màu đỏ sẫm chỉ cơ chế bệnh sinh nổi bật ở BN ĐTĐ típ 2)
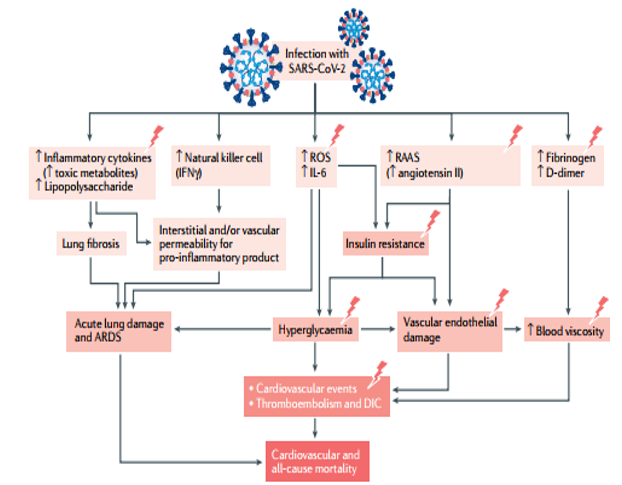
Nhiễm SARS-CoV-2 (coronavirrus 2) với hội chứng suy hô hấp cấp nặng, làm tăng nồng độ trong máu các yếu tố trung gian trong quá trình viêm như: lipopolysaccharide, các cytokines viêm, và các chất chuyển hóa độc. Điều biến hoạt tính tế bào diệt tự nhiên (tăng hoặc giảm) và sản xuất IFN γ có thể tăng tính thấm mạch máu và/hoặc tổ chức kẽ đối với các sản phẩm tiền viêm. Ngoài ra, nhiễm SARS-CoV-2 đưa đến tăng sản xuất ROS (reactive oxygen species), đưa đến xơ phổi, tổn thương phổi cấp và hội chứng suy hô hấp cấp (ARDS). Sản xuất ROS và virus hoạt hóa hệ thống renin-angiotensin-aldossterone (RAAS) (qua việc tăng bộc lộ angiotensin II) gây kháng insulin, tăng glucose máu, tổn thương nội mạc mạch máu, tất cả ngững rối loạn đó tham gia vào các biến cố tim mạch, tắc mạch do huyết khối, đông máu rải rác trong mạch máu (DIC). Nhiễm SARS-CoV-2 cũng làm tăng đóng vón các thành phần của fibrinogen, tăng D-dimer đưa đến tăng độ nhớt của máu, tổn thương nội mạc mạch máu, liên quan với các biến cố tim mạch, tắc mạch do huyết khối, đông máu rải rác trong mạch máu (DIC).
1. Vai trò của tăng glucose máu. (2)
Sự nhạy cảm đối với SARS phụ thuộc trước hết vào ái lực đỉnh gắn ACE2 receptors trong tổ chức đích ở bước tấn công đầu tiên của virus.
ACE2 receptors hiện nay được xác nhận là receptor thu nhận SARS-CoV-2 gây nên COVID-19, khi phối hợp với protease xuyên màng TMPRSS2 (transmembrane protease serine-2) truyền thông tin đến đỉnh protein S của virus tạo thuận lợi cho virus xâm nhập vào tế bào vật chủ.(4)
Quá trình nhiễm virus bắt đầu bằng việc tách protein đỉnh S (spike protein S); là glucoprotein vỏ thành 2 tiểu đơn vị S1 và S2, Tiểu đơn vị S1 gắn với phần N tận cùng ( N-terminal region) của ACE2, tiểu đơn vị S2 tương tác với TMPRSS2 tách protein S cho phép virus đi vào tế bào (hình 4), sau đó RNA của virus (viral RNA) được giải phóng vào tương bào (cytoplasma), tiếp theo là quá trình sao chép của virus. RNA của virus (viral RNA) đi vào nhân tế bào tổng hợp các chuỗi vitral RNA mới và viral proteins. Viral RNA khi đi ra khỏi nhân tế bào, lắp ráp, phát triển và giải phóng virus mới tác động đến nhiều cơ quan. (hình 2) (44)
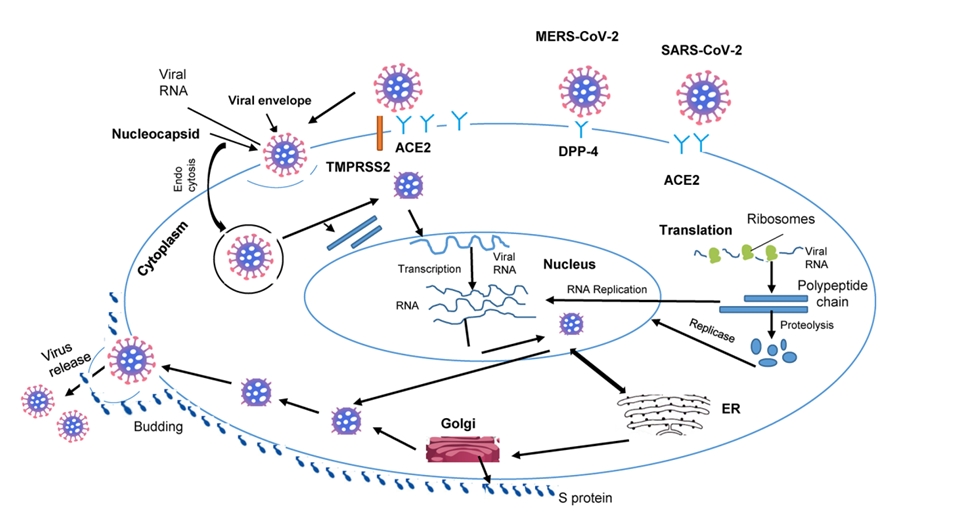
Hình 2. Minh họa con đường tác động của coronavirus. (44)
Giải thích cho sự liên quan giữa tăng glucose máu và nồng độ ACE2 receptors trong COVID-19 nặng là những thay đổi hiện tượng glycosyl hóa (glycosylation) của ACE2r và glycosyl hóa protein đỉnh của virus (viral spike protein). Cả hai hiện tượng này là hậu quả của kiểm soát kém tăng glucose máu, làm thay đổi protein đỉnh của virus gắn với ACEr và mức độ đáp ứng miễn dịch đối với virus. Tăng nồng độ glucose máu có thể làm tăng trực tiếp nồng độ glucose trong dịch tiết đường hô hấp. Theo Brufsky (5), khi kiểm soát kém glucose máu, glycosyl hóa ACE2r trong phổi, đường không khí của mũi (nasal airways), lưỡi, họng (oropharynx) cao sẽ làm tăng vị trí gắn của virus SARS-CoV-2, nhiễm COVID-19 càng tăng nhiều hơn, bệnh càng nặng hơn. Điều này chỉ ra rằng, stress tăng glucose máu (Stress hyperglycemia) ( nghĩa là tăng nhất thời glucose máu ở người có HbA1c < 6,5% sau bị bệnh cấp, hay phẫu thuật sẽ làm cho bệnh cấp tính xấu hơn so với người đã bị ĐTĐ.
Stress hyperglycemia là một trong những yếu tố tiên lượng xấu, kết hợp với tăng có ý nghĩa suy hô hấp và tử vong ở BN bị COVID-19.
Kiểm soát tốt glucose máu sẽ làm giảm nồng độ ACEr bị glycosyl hóa trong phổi, theo đó số lượng vị trí virus bị glycosyl hóa cũng giảm, sẽ cải thiện tình trạng viêm và các triệu chứng bệnh COVID-19.
ACE2 receptors được bộc lộ không chỉ trong tế bào biểu mô phế nang typ-I và typ-II trong phổi và đường hô hấp trên, mà còn bộc lộ ở một vài vị trí khác như tim, nội mô (endothelium ), biểu mô ống thận (renal tubular epithelium), biểu mô kẽ (intestinal epithelium) và tụy.
Trong tụy ACE2 bộc lộ trong tế bào nang (acinar cells) và trong tiểu quần thể (subset) tế bào đảo tụy. Các nghiên cứu tiền lâm sàng cho thấy, tăng hoặc giảm chức năng ACE2 biểu hiện vai trò sinh lý và dược lý của ACE2, cả hai phụ thuộc hoặc không không phụ thuộc vào angiotensin (1-7), nó đối kháng với tác dụng của angiotensin II về kiểm soát glucose, chức năng tế bào, sinh lý thận, huyết áp,VXĐM và cải thiện bệnh ĐTĐ trên thực nghiệm (6,7).
Nhiễm hô hấp cấp do virus sẽ phát triển nhanh kháng inslin tạm thời. Mối liên quan này gợi ý cơ chế tăng glucose máu nhất thời gây nên bởi viêm nhất thời tế bào đảo tụy do SARS-CoV, khi SARS-CoV gắn với ACE receptor có trên tế bào đảo tụy gây nên bệnh ĐTĐ phụ thuộc insulin xẩy ra nhất thời, và sẽ hết sau khi bệnh COVID khỏi.
Tăng glucose máu cũng ảnh hưởng đến chức năng phổi như: làm trầm trọng hơn rối loạn chức năng hô hấp do virus influenza ở BN ĐTĐ. Mô hình thực nghiệm trên động vật, ĐTĐ liên quan với một số thay đổi cấu truc phổi như tăng tính thấm mạch máu và xẹp (collap) phế nang. Câu hỏi đặt ra là, ĐTĐ có liên quan hay không đến mức độ bộc lộ ACEr trong phổi ở người, là vấn đề đang được quan tâm. Rao et al (8).cho rằng ĐTĐ là nguyên nhân làm tăng bộc lộ ACE2 ở phổi.
Mặc dầu, TMPRSS2 có thể có vai trò trong cơ chế bệnh sinh bệnh do virus, tuy nhiên, hiện còn rất ít thông tin về điều hòa hoặc rối loạn điều hòa bộc lộ TMPRSS2 hay là hoạt tính của glucose trong ĐTĐ thực nghiệm hoặc trong lâm sàng. Ở BN ĐTĐ, glucose máu cao, sẽ làm HbA1c tăng, protein bề mặt của SARS-CoV-2 gắn và làm rối loạn nghiêm trọng phân tử hem trong tế bào hồng cầu, bằng cách đó tách sắt (iron) từ phân tử hem để tạo porphyrin trong tế bào hồng cầu, hồng cầu thiếu oxygen và chứa nhiều carbon dioxide, bằng cách đó làm chết tế bào và viêm nặng trong phổi.
Vì BN ĐTĐ và người già hemoglobulin bị glycosyl hóa nhiều hơn, những người này có thể bị ảnh hưởng dễ dàng hơn bởi SARS-CoV-2 gắn và tách sắt từ hem để tạo thành porphyrin, các receptor khác (CD147 hoặc basigin) cũng có thể tham gia vào những rối loạn này (9).
2. Rối loạn chức năng tế bào T và tăng nhạy cảm đối với tình trạng tăng viêm.
Hoạt hóa các cytokines tiền viêm hoặc hóa động (chemokines) là nguyên nhân gây nên chết tế bào theo chương trình, hoại tử và khởi động phản ứng viêm, điều động các tế bào viêm. Qua việc sản xuất interferon γ (IFNγ), tế bào CD4T helper (Th1) tham gia điều hòa trình diện kháng nguyên chống lại các yếu tố gây bệnh (pathogens) trong tế bào như CoV, tế bào Th17 sản xuất interleukin-17 (IL17), IL21, và IL22 (10) điều động neutrophils và macrophages .
Bệnh nhân bị COVID-19 nặng có rối loạn phản ứng interferon typ-1, hoạt tính IFN-α trong máu thấp, có thể do nồng độ virus trong máu cao và rối loạn phản ứng viêm. Y văn cũng đã ghi nhận rằng, sai sót bẩm sinh (inborn errors) miễn dịch interferon typ-1 liên quan với TLR3 và IRF7, hoặc miễn dịch tế bào B, là nguyên nhân gây tử vong ở BN bị bệnh phổi do COVID-19 (12,5% ở nam và 2,6% ở nữ). (14)
SARS-CoV-2 làm tăng chết theo chương trình các lymphocytes (các tế bào CD3, CD4 và CD8) ảnh hưởng xấu đến các tế bào miễn dịch trong máu, làm giảm lymphocytes trong máu (lymphocytopenia).
Chức năng tế bào T giảm đưa đến giảm ức chế hệ thống miễn dịch bẩm sinh, hậu quả là tiết một lượng lớn các cytokines viêm, hiện tượng này gọi là “ cơn bão cytokine (cytokine storm )” . ĐTĐ kìm hãm hóa ứng đông bạch cầu trung tính (neutrophil chemotaxis), kìm hãm tiêu diệt vi khuẩn trong tế bào và thực bào (phagocytosis), lúc mới bắt đầu hoạt hóa miễn dịch qua trung gian tế bào Th1 muộn, về sau là phản ứng tăng viêm thường xẩy ra ở BN ĐTĐ.
Cơn bão cytokines (cytokine storm) là biến chứng hết sức nguy hiểm, đe dọa mạng sống BN. Nghiên cứu hồi cứu 317 BN bị COVID-19 xác định bằng xét nghiệm cho thấy những dấu hiệu phản ứng viêm cấp tính (tăng IL-6 và lactate dehydrogenase) trong 24 giờ từ khi nhập viện, tương quan với mức độ nặng của bệnh (15). Như đã biết, IL-6 là yếu tố tiền viêm trong miễn dịch bẩm sinh (innate immunity), nồng độ của nó có thể tương quan với mức độ nặng của bệnh, tương quan với các thông số đông máu. Tăng stress oxy hóa, IL-6 có thể gây tổn thương các proteine, lipid và DNA , rối loạn cấu trúc và chức năng của cơ thể , làm cho bệnh COVID-19 ở BN ĐTĐ tiến triển nặng rất nhanh (hình-1). Đặc biệt, đánh giá sinh học một cách hệ thống về miễn dịch học ở BN bị COVID-19 nặng cho thấy tăng nồng độ DNA vi khuẩn và lipopolysaccaride trong huyết thanh, tương quan thuận với nồng độ IL-6 cũng như EN-RAGE, một marker sinh học trong hội chứng suy hô hấp cấp (ARDS) do nhiễm khuẩn huyết (sepsis-induced ARDS). Những biểu hiện này ghi nhận vai trò của các sản phẩm của vi khuẩn, có lẽ nguồn gốc từ phổi làm tăng sản xuất các cytokines viêm trong COVID-19 nặng.
Hội chứng suy hô hấp cấp (ARDS) có đặc điểm phù nặng thành phế nang và nhu mô phổi (lung parenchyma), tăng mạnh các thông số viêm như C-reactive protein, tốc độ lắng hồng cầu (ESR), hoặc tăng các markers viêm khác như D-dimer, Ferritin, và IL-6, làm tăng nguy cơ các biến chứng vi mạch và mạch máu lớn do tình trạng viêm mạch mức độ thấp ở những BN có bệnh nền là ĐTĐ. Trong một công trình nghiên cứu toàn quốc ở Pháp (17), biến chứng vi mạch và mạch máu lớn do bệnh ĐTĐ liên quan có ý nghĩa với tăng nguy cơ tử vong ở BN COVID-19. (hình 1).
Những dấu hiệu thường gặp nhất ở phổi BN COVID-19 nghiên cứu qua mổ tử thi cho thấy những tổn thương viêm do COVID-19: tổn thương phế nang lan tỏa, thâm nhiễm tế bào viêm với màng hyaline chiếm ưu thế, thâm nhiễm cơ tim, thâm nhiễm lymphocytes trong gan, macrophage thâm nhiễm đầy trong não, tổn thương sợi trục thần kinh (axonal injuries), vi huyết khối trong thận, và viêm tụy thành ổ. (hình-1). (1)
3. Điều biến miễn dịch (immunomodulation) và Kháng inslin.
Y văn đã ghi nhận rằng. Cơ chế điều hòa chức năng miễn dịch là cơ chế liên kết COVID-19 với cả ĐTĐ típ 1 và típ 2. Ví dụ:
Tuổi là yếu tố nguy cơ quan trọng đối với phát triển bệnh ĐTĐ típ 2. Tuổi già ảnh hưởng đến chức năng miễn dịch , đến tính nhạy cảm và mức độ nặng nhiễm COVID-19. Tăng đường huyết làm rối loạn tình trạng miễn dịch liên quan đến các biến chứng mạch máu lớn do ĐTĐ.
Những người béo phì, các cytokines tiền viêm, cùng với tín hiệu tế bào T helper type-1 đã được chứng minh làm tăng tình trạng kháng insulin (18), tuy nhiên, vai trò của các cytokines này trong COVID-19 chưa rõ, bằng cách nào để nhiễm SARS-CoVi-2 làm mất kiểm soát glucose để phát triển thành bệnh ĐTĐ ở những BN có nguy cơ bị bệnh ĐTĐ cũng chưa rõ.
Một nghiên cứu đã chứng minh, nhiễm virus hô hấp cấp làm tăng sản xuất IFN-γ, là nguyên nhân gây kháng insulin tại cơ ở người, tuyến tụy tăng tiết bù insulin để duy trì glucose máu trong giới hạn bình thường và tăng miễn dịch kháng virus qua kích thích trực tiếp tế bào T CD8. Những BN bị rối loan dung nạp glucose hoặc ĐTĐ cơ chế bù trừ này thất bại. (16). Như vậy, trong nhiễm SARS-CoV-2 miễn dịch kháng virus (qua T CD8), và những phản ứng viêm có thể làm thay đổi tính nhạy cảm insulin, phát sinh tình trạng kháng insulin, làm nặng thêm rối loạn chuyển hóa glucose đưa đến stress tăng glucose máu (hình-1).
Điều đáng chú ý là, virus hợp bào hô hấp (respiratory syncytial viruses) làm tăng sản xuất IFN-γ, và hoạt hóa tế bào diệt tự nhiên (natural killer –NK) như là cơ chế bảo vệ (19), cả hai làm tăng sản xuất IFNgamma, và hoạt hóa tế bào NK làm cho tình trạng viêm hệ thống trở nên trầm trọng hơn trong tổ chức cơ và mỡ, làm rối loạn chuyển hóa glucose ở những cơ quan này, hơn nữa, có mối liên quan giữa hoạt tính tế bào NK với kiểm soát glucose với BN rối loạn chuyển hóa glucose, ví dụ, hoạt tính tế bào NK thấp hơn ở BN ĐTĐ típ 2 so với người rối loạn dung nạp glucose và người dung nạp glucose bình thường. Ngoài ra, một phân tích gộp hồi cứu đã chứng minh nồng độ HbA1C là yếu tố dự báo độc lập của hoạt tính tế bào NK ở BN ĐTĐ típ (20). Như vậy, những người bị rối loạn dung nạp glucose hoặc ĐTĐ típ 2 bị giảm hoạt tính tế bào NK, điều này có thể giúp giải thích tại sao BN bị ĐTĐ nhạy cảm hơn với COVID-19, và có tiên lượng xấu hơn so với những người không bị ĐTĐ.
4. Renin-Angiotensin-Aldosterone system (RAAS). (được trình bày trong hình 3)
ACE2 một phần của hệ thống RAAS (hình-1), đang thu hút sự quan tâm vì nó có chức năng như là receptor đi vào (entry receptor) của SARS-CoV cũng như SARS-Cov-2. ACE-2 lúc đầu được cho là bộc lộ chủ yếu trong hệ thống hô hấp, tuy nhiên, những nghiên cứu bằng phương pháp phân tích hóa tổ chức miễn dịch (immuno-histochemical analyses) đã cho thấy ACE-2 bộc lộ chủ yếu trong ruột non, thận, cơ tim, mạch máu và tế bào tụy, nhưng bộc lộ ít trong hệ thống hô hấp,
Có sự kết hợp giữa ACE-2 và điều hòa chuyển hóa glucose. Ví dụ, chuột bị knockout ACE2 nhạy cảm hơn chuột hoang đã bị rối loạn chức năng tuyến tụy do chế độ ăn nhiều mỡ về chuyển hóa glucose, hơn nữa, nhiễm SARD-CoV có thể gây nên tăng đường huyết ở những người không bị ĐTĐ trước đó (21). Mặt khác, bộc lộ ACE2 trong tụy nội tiết, có thể cho rằng coronaviruses có tiềm năng làm tăng đường huyết, nhiều thông báo lâm sàng cho thấy tăng đường huyết có thể kéo dài tới 3 năm sau khi SARS được phục hồi (21), có lẽ do tổn thương tế bào β tụy trong thời gian dài, và ACE2 là một phần của RAAS có thể tham gia trong sự kết hợp giữa ĐTĐ và COVID-19 (hình 3).
Về các thuốc nhóm ACEinhibitors / ARBS. Chưa có bằng chứng về nguy cơ hay lợi ích, Hội tim Hoa kỳ, Trường môn tim hoa kỳ và Hội tăng HA Hoa kỳ đã khuyến cáo rằng BN tiếp tục điều trị các thuốc thông thường điều trị THA của mình như ACE inhibitors hoặc ARBs (11), theo những nghiên cứu hiện nay (3) ACE inhibitors cho BN COVID-19 liên quan đến giảm tử vong sau khi xuất viện (không liên quan với ARBs).
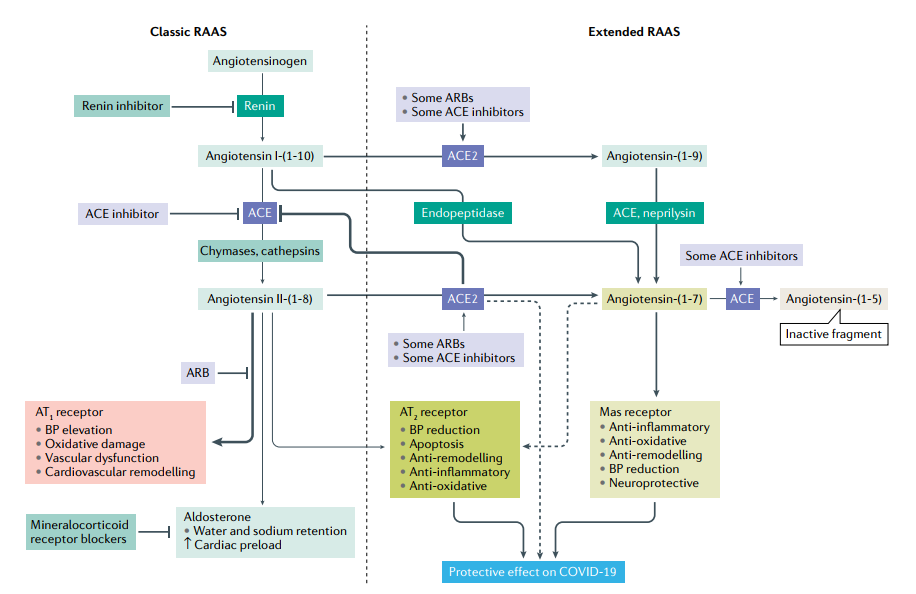
Hình 3. Vai trò của ACE2 trong RAAS.Vì Angiotensin converting enzyme 2 (ACE-2) là receptor quan trọng của SARS-CoV-2 trong hội chứng suy hô hấp cấp do coronavirus-2 tạo thuận lợi thâm nhiễm của một số tế bào liên quan như tế bào phổi, điều này rất quan trọng để hiểu chức năng sinh lý bình thường của chúng. Ức chế ACE sẽ block chuyển hóa của angiotensin-(1-7) sang angiotensin-(1-5), như vậy sẽ tăng angiotensin-(1-7) trong huyết tương và trong tổ chức. Mô hình thực nghiệm trên động vật: Angiotensin (1-7) làm tăng dãn mạch và ức chế tác dụng co mạch của angiotensin II. Nghiên cứu ex vivo ở động mạch vú trong của người cho thấy, angiotensin(1-7) block co mạch do tác dụng của angiotensin II và ức chế ACE trong tổ chức tim mạch của người.. nghiên cứu ex vivo, angiotensin (1-7) và một số ACE inhibitors như quinaprilat và captopril có khả năng bradykinin làm hạ huyết áp do ức chế ACE. Như vậy, angiotensin (1-7) tác động như là yếu tố ức chế ACE và có thể kích thích giải phóng bradykinin, những kết quả này cho thấy angiotensin (1-7) có thể là yếu tố điều biến quan trọng hệ thống RAAS ở người. Những chữ viết tắt: ARB: angiotensin receptor blocker, AT1: angiotensin typ-1, AT2: Angiotensin typ-2, BP : Blood pressur.
5. Tăng mức độ nặng của COVID-19.
Hai đợt sớm BN bị bệnh COVID-19 nặng vào ICU ở Mỹ, tỷ lệ ĐTĐ là 58% và 33% (22,23), chứng tỏ có liên quan giữa COVID-19 nặng và ĐTĐ. Một vài cơ chế tham gia làm cho triệu chứng lâm sàng COVID-19 nặng hơn ở BN ĐTĐ (hình-4) (1). Như đã biết, nhiễm độc glucose, tổn thương nội mạc do viêm, stress oxy hóa và sản xuất cytokine làm tăng nguy cơ biến chứng tắc mạch do huyết khối, gây tổn thương các cơ quan sống ở BN ĐTĐ (hình-1). Ngoài ra, các loại thuốc sử dụng trong điều trị COVID-19 như corticoid toàn thân hoặc các thuốc chống virus có thể làm xấu đi tình trạng tăng glucose máu.
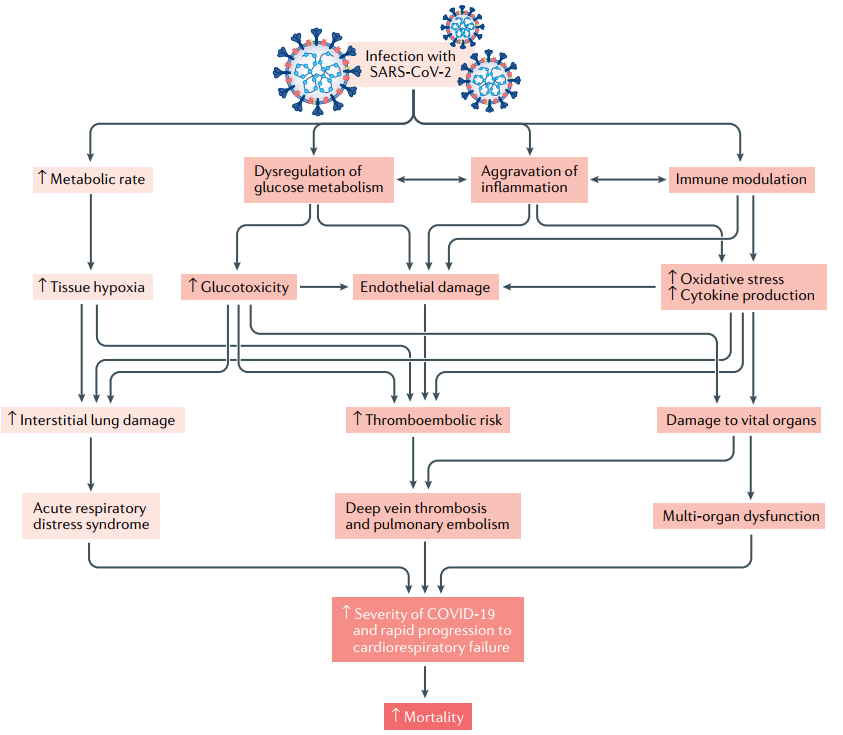
Hình 4. Tiến triển lâm sàng BN ĐTĐ sau khi nhiễm SARS-CoV-2. (ô màu đỏ sẫm chỉ tiến triển ở BN ĐTĐ typ-2) Hội chứng hô hấp cấp, nặng do SARS-CoV-2 làm tăng tốc độ chuyển hóa đưa đến thiếu oxy tổ chức (tissue hypoxia), hypoxia tổ chức gây nên tổn thương phổi kẽ và hội chứng suy hô hấp cấp. BN ĐTĐ bị nhiễm coronavirus có rối loạn cân bằng nội môi glucose, làm trầm trọng thêm quá trình viêm và rối loạn chức năng miễn dịch. Những rối loạn này làm tăng stress oxy hóa, sản xuất cytokine, và rối loạn chức năng nội mạc, đưa đến tăng nguy cơ tắc mạch do huyết khối và tổn thương cơ quan sống. Những rối loạn này tham gia làm tăng mức độ nặng của COVID-19, tiến triển nhanh tới suy tim-phổi ở BN ĐTĐ.
Nghiên cứu hồi cứu, đa trung tâm ở Trung quốc cho thấy, nồng độ glucose máu lúc đói (≥ 7mmol/L, ≥ 126mg/dL) khi nhập viện là yếu tố dự báo độc lập của tăng tỷ lệ tử vong ở BN COVID-19 không bị ĐTĐ. Vì vậy, phải hết sức theo dõi cẩn thận nồng độ glucose và điều trị ngay khi đường huyết có xu hướng tăng ở BN COVID-19 tiến triển nặng.
Trong điều trị COVID-19 nặng, điều trị bằng corticosteroid dexamethasone làm giảm tỷ lệ tử vong ở những BN thông khí cơ học xâm nhập (invasive mechanical ventilation) 36% (HR 0,64, 95% CI 0,51-0,81), những người thở oxygen chỉ giảm 18% (HR 0,82,95% CI 0,72-0,94). Điều trị bằng glucocorticoid có lẽ làm giảm sản xuất cytokines và đề phòng những diễn biến xấu có thể xẩy ra ở những BN COVID-19 nặng. Tuy nhiên, corticosteroids là nhóm thuốc làm tăng đường huyết, do vậy, những nghiên cứu sau này cần phải nghiên cứu tỷ mỉ hơn, đặc biệt BN bị ĐTĐ để có chỉ định và theo dõi thích hợp.
6. Các biến cố tắc mạch do huyết khối.(Thromboembolic events)
Các bằng chứng cho thấy COVID-19 làm tăng các biến cố tắc mạch do huyết khối, và là nguyên nhân chủ yếu gây tử vong. Bằng chứng đầu tiên là bất thường các thông số về đông máu liên quan với COVID-19 được thông báo trong các nghiên cứu tại Trung quốc. Ví dụ: Đặc điểm cơ bản của 99 BN đầu tiên được nhập viện tại Vũ Hãn cho thấy: 6% tăng hoạt hóa thời gian thromboplastin riêng phần (activated partial thromboplastin time), 5% tăng prothrombin, 36% tăng D-dimer. Những BN tử vong do COVID-19 tăng có ý nghĩa thống kê nồng độ D-dimer và các sản phẩm thoái dáng fibrin, trong nghiên cứu này đối tượng là những BN người Trung quốc tuổi trung bình bị COVID-19, trên 71% BN này tử vong với đầy đủ triệu chứng về Hội chứng đông máu rải rác trong mạch máu (disseminated intravascular coagulation), chỉ có 0,6% sông sót, Nhiều nghiên cứu khác cũng cho thấy tỷ lệ tắc mạch do huyết khối tĩnh mạch ở BN nhiễm COVID-19 rất cao (24).
Phản ứng viêm khi nhiễm SARS-CoV2 đưa đến rối loạn đông máu, từ những thay đổi nhẹ các thông số đông máu đến đông máu rải rác trong lòng mạch, với triệu chứng của huyết khối và / hoặc suy nhiều cơ quan.(39). Rối loạn chức năng nội mạc mạch máu hình như tham gia vào cơ chế bệnh sinh những thay đổi vi tuần hoàn ở người nhiễm SARS-CoV2. Điều quan trọng là, SARS-CoV2 đi vào và tác động đến tế bào nội mạc qua ACE2 receptor, với sự sao chép của virus gây nên thâm nhiễm tế bào viêm, chết theo chương trình tế bào nội mạc và gây huyết khối trong vi mạch (40). Nghiên cứu trên tử thi BN tử vong vì nhiễm SARS-CoV2 cho thấy thể vùi virus trong tế bào nội mạc và thâm nhiễm các tế bào đơn nhân, bạch cầu hạt biệt lập, với hình ảnh tế bào nội mach chết theo chương trình (40). Như vậy, các bằng chứng gợi ý rằng, tăng giải phóng các yếu tố đông máu, rối loạn chức năng điều hòa và phá hoại cấu trúc tế bào nội mạc là cơ chế chính làm tăng tắc mạch do huyết khối ở BN COVID-19 (39). Rối loạn chức năng nội mạc có thể là nguyên nhân về biến chứng mạch máu não ở những BN trẻ hơn và những BN bị thiếu máu cơ tim và/hoặc biến chứng tắc mạch do huyết khối.
Nguy cơ tắc mạch do huyết khối ở BN ĐTĐ.
Nhiều báo cáo đã ghi nhận, tăng nguy cơ tắc mạch do huyết khới trong số BN ĐTĐ ngoài những triệu chứng đặc biệt của nhiễm SARS-CoV2. Nghiên cứu cộng đồng cho thấy, BN ĐTĐ typ-2 tăng nguy cơ tắc mạch huyết khối tĩnh mạch so vơi đối chứng (HR 1,4, 95% CI 1,27-1,63), hơn nữa, những nguy cơ tắc mạch phổi (pulmonary embolism) gặp nhiều hơn ở BN ĐTĐ typ-2 hơn đối chứng (HR 1,52 95% CI 1,22-1,90).(41) Một nghiên cứu khác cho thấy, tỷ lệ mới mắc huyết khối tĩnh mạch sâu (DVT) sau thay khớp gối toàn bộ tăng hơn có ý nghĩa thống kê ở BN ĐTĐ so với người không bị ĐTĐ (42), tăng 2 lần nguy cơ loét sau DVT. Như vậy, ĐTĐ được xếp vào loại nguy cơ cao đối với biến cố tắc mạch do huyết khối hoặc đột quỵ. (43).
Để đề phòng những biến chứng như vậy, những BN ĐTĐ có nguy cơ cao nhiễm SARS-CoV-2 cố gắng không ngồi nhiều một chỗ trong thời gian dài, hoạt động thể lực đều đặn, tham gia những bài tập thể dục thích hợp, duy trì tập thể dục thường xuyên tại nhà sẽ giúp giảm tỷ lệ tắc mạch do huyết khối. Những BN đau chi dưới, thở nông hoặc đau ngực phải đến ngay bác sỹ, vì đấy có thể là những triệu chứng do biến chứng tắc mạch do huyết khối. Về vấn đề tăng nguy cơ tắc mạch do huyết khối ở BN ĐTĐ nhiều tác giả khuyên các thầy thuốc đánh giá sớm về tình trạng đông máu sớm để kê đơn kịp thời, các thuốc chống đông (anticoagulant therapy) như heparin trọng lượng phân tử thấp cho tiên lượng tốt hơn ở những BN bị nhiễm COVID-19 nặng có nguy cơ cao tắc mach do huyết khối, như những BN có tăng nồng độ D-dimer, vì vậy, nên bắt đầu điều trị anticoagulant trong bệnh viện cho BN có nhiễm COVID-19 trung bình hoặc nặng.
Mặc dầu bằng chứng ủng hộ cho ý kiến về tác dụng trực tiếp của GLP-1 analogues đối với nguy cơ tắc mạch do huyết khối còn hạn chế, một vài nghiên cứu thực nghiệm trên động vật cho thấy điều trị bằng GLP-analogues ngăn cản bệnh vữa xơ, ổn định mảng vữa xơ ở động mạch cảnh và cung động mạch chủ.
Điều trị GLP- in vitro làm giảm bộc lộ matrix methaloproteinase-2 và MCP-1 và chuyển vị (translocation) NF-kB-p65 là nguy cơ cao của tắc mạch do huyết khối. Nghiên cứu kết cục tim mạch cho thấy, điều trị bằng dulaglutide là một GLP-1 analogue tác dụng dài làm giảm tỷ lệ mới mắc đột quỵ ở BN ĐTĐ typ-2, đồng thời nó cũng sẽ có lợi khi chọn điều trị cho BN ĐTĐ giảm nguy cơ các biến cố tắc mạch do tăng đông máu.
7- Các thuốc hạ đường huyết và cơ chế bệnh sinh SARS-Co-V2
Một số thuốc hạ đường huyết điều trị bệnh ĐTĐ có thể có tác dụng trên cơ chế bệnh sinh COVID-19, như RAAS đã trình bày ở phần trước, thuốc liên quan với enzyme DPP4. Xin được trình bày nhóm thuốc liên quan với enzyme DPP4 để tham khảo, những tác dụng này cũng có thể gợi ý để áp dụng trong điều trị BN ĐTĐ và COVID-19.
7-1 Diphenyl peptidase 4. (DPP4).
Enzyme DPP4 đã được chứng minh có chức năng quan trọng trong cân bằng nội môi glucose, về miễn dịch, DPP4 như là chỉ dấu về lymphocytes đã được hoạt hóa, và là yếu tố điều hòa sự bộc lộ của nhiều hóa động sinh (chemokines) như CCL5, CXCL12, CXCL2 (GRO-b) và CXCL11 (I-TAC).
Các thuốc ức chế enzyme DPP4 (DPP4 inhibitors) đang thịnh hành trong lâm sàng điều trị bệnh ĐTĐ typ-2.
Dựa trên nhiều báo cáo về nhiễm khuẩn đường hô hấp trên, lo lắng ngày càng tăng về nguy cơ nhiễm virus khi điều trị DPP4 inhibitors (27), tuy nhiên, bằng chứng trên nhiều nghiên cứu lâm sàng về liên quan giữa điều trị DPP4is với nguy cơ viêm phổi mắc phải cộng đồng ở BN ĐTĐ typ-2 đã không xác định có tăng nguy cơ.(28)
– Mặc dầu ACE2 được công nhận như là receptor chủ yếu để SARS-CoV-2 đi vào trong tế bào, DPP4 cũng gắn với SARS-CoV2 như vai trò một receptor (?) (29). Liệu DPP4is ảnh hưởng đến chức năng DPP4 (được xem như là receptor của virus SARS) hay không là vấn đề đang được bàn luận nhiều.
– Sự bộc lộ DPP4 trong lách, phổi, gan, thận và một số tế bào miễn dịch hình như bị thay đổi ở BN ĐTĐ typ-2. DPP4 không phải là protein màng tế bào, nhưng đi vào trong tuần hoàn là DPP4 thể hòa tan (soluble DPP4). Nồng độ soluble DPP4 tăng do DPP4is ở chuột (31). Liệu soluble DPP4 có thể có vai trò như là receptor của virus , hoặc có vai trò bảo vệ trong nhiễm SARS-CoV2 hay không, chưa hiểu biết được hoàn toàn, trong một nghiên cứu in vitro (30), điều trị bằng DPP4is sitagliptin, vildagliptin hoặc saxagliptin đã không ngăn cản được sự xâm nhập của coronaviruses vào trong tế bào. Vì vậy, đây là vấn đề cần được quan tâm nghiên cứu sâu , kỹ hơn để hiểu đầy đủ vai trò của DPP4is trong điều trị BN bị COVID-19 và ĐTĐ typ-2, để có chỉ định điều trị thích hợp.
– Tương tác giữa DPP4 và RAAS (kể cả ACE2) chưa được nghiên cứu cẩn thận, đầy đủ, nhưng hình như có khả năng có liên quan, có tương tác. DPP4 và RAAS có liên quan với nhau về di truyền (genetically), liên quan về nguy cơ nhiễm SARS-CoV-2 và khả năng bệnh tiến triển nặng của COVID-19, đặc biệt ở BN ĐTĐ . Mối liên quan này được củng cố bằng những biểu hiện : Bộc lộ DPP4 tăng trong lymphocytes máu ở BN bị ĐTĐ typ-2, tương quan với kháng insulin, và tăng DPP4 ở động vật thực nghiệm ĐTĐ làm rối loạn đáp ứng miễn dịch (32).
– Điều trị bằng DPP4is đã được chứng minh trung tính đối với các biến cố tim mạch ở BN ĐTĐ typ-2. Tuy nhiên, DPP-4 inhibitors đã được ghi nhận có lợi trên hệ thống tim mạch như giảm stress oxy hóa và endoplasmic reticulum stress vì tác dụng chống viêm của nó (26, 33). đặc biệt hơn, vùng gắn receptor của DPP4 tương tác với adenosine deaminase (ADA) trong các tế bào T CD4 và CD8 của người, những biểu hiện này chỉ ra có khả năng điều biến hệ thống miễn dịch vật chủ bởi SARS-CoV-2 qua việc gắn với DPP4 và cạnh tranh với vị trí nhận dạng của ADA (ADA recognition site). Như vậy, vùng gắn receptor DPP4 có thể là đích chiến lược tiềm năng điều trị nhiễm SARS-CoV-2 (34).
– Thực nghiệm trên chuột, DPP4is làm tăng nồng độ trong tuần hoàn các markers viêm ở mô hình chuột cho chế độ dinh dưỡng điều hòa, ngược lại, ở người, điều trị bằng DPP4is làm giảm hoạt tính enzyme DPP4, nhưng không làm tăng nồng độ các markers viêm (35), những phát hiện này gợi ý khả năng có sự phân ly giữa hoạt tính enzyme DPP4, sử dụng DPP4i và các markers viêm giữa người và trên chuột thực nghiêm.. Tuy nhiên, điều trị bằng DPP4is kìm hãm đáp ứng miễn dịch tế bào T đối với virus trong nghiên cứu máu ngoại vi người, một nghiên cứu trên người (36) cho thấy nồng độ lưu hành trong máu của brain-derived neurotrophic factor giảm do DPP4is (36), vì vậy, tác dụng của DPP4is trên chức năng tế bào T, đáp ứng miễn dịch và viêm trung gian qua tế bào T ở BN COVID-19 cần được nghiên cứu sâu hơn.
– Những hiểu biết hiên nay không gợi ý về an toàn khi kết hợp sử dụng DPP4is cho BN COVID-19 và ĐTĐ typ-2. Mặc dù, trong một nghiên cứu hồi cứu đối chứng ở bắc Ý (37), sitagliptin điều trị trong bệnh viện đã làm giảm tỷ lệ tử vong và cải thiện các kết cục lâm sàng ở những BN ĐTĐ típ 2 bị COVID-19., nhiều công trình khác ở Ý cũng đã mô tả sự kết hợp giữa điều trị DPP4is với giảm có ý nghĩa thống kê về tử vong, tuy nhiên kết quả này chỉ dựa trên 11BN, trong đó có 1 trường hợp tử vong, tuy nhiên, điều tri bằng DPP4is kết hợp với xấu đi các kết cục ở 27 BN ĐTĐ typ-2 điều trị bằng DPP4is hơn là 49 BN được điều trị bằng các thuốc hạ đường huyết khác. Ý kiến chưa đồng thuận,Vì vậy, những nghiên cứu lâm sàng, ngẫu nhiên, đối chứng (RCTs) ở những cộng đồng khác nhau của bệnh ĐTĐ typ-2 và COVID-19 là rất cần thiết để đánh giá lợi ích tiềm năng sống còn liên quan với DPP4i ở BN COVID-19, có tác dụng với BN không bị ĐTĐ hay không?
7-2 Glucagon-like peptide-1 và đồng vận của nó.
Ở BN ĐTĐ typ-2, hầu hết các đồng vận GLP-1 làm giảm các kết cục tim mạch chính, tham gia vào cân bằng nội môi glucose, có tác dụng đa hướng( như trên chức năng miễn dịch, quá trình viêm . Ở người GLP-1receptors phân bố rộng rãi trong các tế bào và cơ quan khác nhau như thận, phổi, tim, tế bào nội mạc và tế bào thần kinh.
Điều trị bằng GLP-1 làm giảm sản xuất các cytokines viêm khác nhau và giảm thâm nhiễm các tế bào miễn dịch trong gan, thận, phổi, não và hệ thống tim mạch. Trên mô hình thực nghiệm trên động vật về VXĐM, đồng vận của GLP-1 Exendin 4 làm giảm căn bản tích lũy monocytes và macrophages trong thành mạch máu và ức chế VXĐM do điều hòa quá trình viêm trong macrophages , ngoài ra, Exendin 4 còn có tác dụng bảo vệ thận trên mô hình thực nghiệm trên động vật do ức chế hoạt tính yếu tố nhân Kb (nuclear factor-Kb (NF-Kb) trong thận, tăng hoạt tính NF-Kb như đã biết tham gia đan xen giữa viêm và stress oxy hóa. In vitro, điều trị bằng liraglutide làm giảm bộc lộ vascular cell adhesion molecule-1 (VCAM-1) trong tê bào nội mạc động mạch chủ người sau khi được kích thích bằng lipopolysacharide hoặc tumor necrosis factor (TNF), ngoài ra, liraglutide cho chuột C57BL/6 với chế độ ăn nhiều mỡ làm giảm viêm và giảm tích mỡ trong tim (38).
Truyền GLP1 tự nhiên (native) cho BN ĐTĐ typ-1 làm giảm nồng độ IL-6, VCAM-1 và những markers stress oxy hóa trong huyết tương. Ở người, GLP-1 và GLP-1 analogues đã được chứng minh có lợi khi điều trị các bệnh viêm mạn tính như: bệnh gan nhiễm mỡ không do rượu, VXĐM, và những rối loạn gây thoái hóa thần kinh, những tác dụng này trung gian qua giảm hoạt tính các con đường do viêm.
Liệu những tác dụng như vậy trên quá trình viêm mức độ thấp liên quan với VXĐM có thể có tác dụng chống viêm liên quan với bệnh COVID-19 hay không vẫn là một câu hỏi cần nghiên cứu. Chính vì vậy, hiện còn rất ít ý kiến khuyên tiếp tục chỉ định GLP-1 analogues cho BN ĐTĐ và COVID-19.
Tuy nhiên, BN bị CVD hoặc bệnh thận có tiên lượng xấu trong diễn biến bệnh COVID-19 so với những người không bị những bệnh này., vì vậy, bảo vệ hệ thống tim mạch, thận ở những người có nguy cơ cao đối với nhiễm SARS-CoV2 cần được hết sức chú ý, cho rằng, vì lợi ích của GLP-1 analogues đối với đề phòng các bệnh CVD và thận đã được xác định, các loại thuốc này sẽ là ý tưởng để điều trị dự phòng những BN ĐTĐ, bệnh thận có những nguy cơ nhiễm SARS-CoV-2 .
Trong đại dịch COVID-19 những người thừa cân, béo phì có một số bất lợi., ví dụ. sự hiện diện viêm mức độ thấp, tổn thương hệ thống miễn dịch , những người bị COVID-19 và béo phì compliance phổi thấp hơn, kết cục về sức khỏe xấu hơn so với người không béo phì. Vì vậy, GLP-1 analogues có thể chỉ định cho BN ĐTĐ typ-2 và béo phì vì nó có tác dụng giảm cân. Tuy nhiên, bắt đầu và duy trì điều trị như vậy trong tình trạng cấp và nặng (như COVID-19 nặng) là không khuyên dùng vì tác dụng chậm, phải chỉnh liều, có thể gây buồn nôn hoặc nôn.
KẾT LUẬN
- Coronvirus-2 (SARS-Co-V2) là một loại siêu vi khuẩn mới, biến thể liên tục, đang gây nên một đại dịch trên toàn cầu, Việt Nam ta cũng không ngoại lệ, đang là thảm họa cho sức khỏe, kinh tế, xã hội, đặc biệt ở những nước đang phát triển và nghèo, cướp đi sinh mạng hàng triệu triệu sinh mạng trên toàn cầu. Tuy bệnh lúc đầu có thể rất nhẹ, không có triệu chứng gì đáng ngại, nhưng bệnh có thể tiến triển rất nhanh, cấp tính, đòi hỏi phải can thiệp kịp thời, khẩn trương, tích cực.
- SARS-CoV-2 sử dụng SARS-CoV receptor ACE2 để đi vào trong tế bào vật chủ (có ý kiến cho rằng DPP4 cũng có thể có vai trò receptor của SARS-CoV?), gây nên một loạt rối loạn rất nặng về chuyển hóa như: gây cơn bão cytokines (cytokine storm), rối loạn đông máu, stress oxy hóa, sản xuất ROS và virus hoạt hóa hệ thống renin-angiotensin-aldossterone (SAAS) (qua việc tăng bộc lộ angiotensin II) gây kháng insulin, stress tăng glucose máu (stress hyperglycemia), v. v , biểu hiện trên lâm sàng là những trạng thái bệnh lý rất nặng như: Hội chứng suy hô cấp nặng, tăng đột biến glucose máu có thể đưa đến hôn mê do tăng đường huyết (Ketoacidosis) ở người ĐTĐ và cả không bị ĐTĐ, tắc nghẽn mạch do đông máu , đông máu rải rác trong lòng mạch, …và cuối cùng gây suy đa tạng do tổn thương nhiều cơ quan dẫn đên tử vong.
- Bệnh ĐTĐ, đặc biệt ĐTĐ típ 2 là nguy cơ đối với COVID-19, người bị ĐTĐ dễ bị nhiễm SARS-CoV2, khi bị nhiễm COVID-19 bệnh ĐTĐ tiến triển xấu hơn. Bệnh COVID-19 sẽ nặng hơn rất nhiều khi phối hợp với bệnh ĐTĐ, vì những mối liên quan qua lại về bệnh sinh giữa hai bệnh.
- Tuy chưa trình bày được hoàn toàn về cơ chế bệnh sinh của COVID-19, đặc biệt khi phối hợp với bệnh ĐTĐ, một số thông tin trong bài này, hy vọng giúp các đồng nghiệp hiểu thêm về bệnh sinh của bệnh để có chiến lược điều trị hợp lý, thu được kết quả tốt hơn./.
TÀI LIỆU THAM KHẢO
- Soo Lim , Jae Hyun Bae , Hyuk-Sang Kwon and Michael A. Nauck . COVID-19 and diabetes mellitus: from pathophysiology to clinical management . naTure revIewS | ENDOCRINOlOGY R e v i e w s volume 17 | January 2021 | .
- Salvatore Corrao 1,2*, Karen Pinelli 1, Martina Vacca 1, Massimo Raspanti 1 and Christiano Argano. Type-2 diabetes mellitus and COVID-19 : A narrative review. Frontiers in Endocrinology | www.frontiersin.org 1 March 2021 | Volume 12 | Article 609470.
- Mandeep R, Mehra MR, Desai SS, Kuy S, Henry TD, Patel AN. Cardiovascular Disease, Drug Therapy, and Mortality in Covid-19. N Engl J Med (2020)382 (26):2582. doi: 10.1056/NEJMc2021225
- Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell (2020) 181(2):271– 80.e8. doi: 10.1016/j.cell.2020.02.052
- Brufsky A. Hyperglycemia, hydroxychloroquine, and the COVID-19 pandemic. J Med Virol (2020) 92(7):770–75. doi: 10.1002/jmv.25887.
- Jiang F, Yang J, Zhang Y, Dong M, Wang S, Zhang Q, et al. Angiotensin converting enzyme 2 and angiotensin 1-7: novel therapeutic targets. Nat Rev Cardiol (2014) 11(7):413–26. doi: 10.1038/nrcardio.2014.59
- Liu F, Long X, Zou W, Zhang W, Chen X, Zhang Z, et al. Highly ACE2 Expression in Pancreas May Cause Pancreas Damage After SARS-CoV-2 Infection. medRxiv (2020), 2020.02.28.20029181
- Rao S, Lau A, So H-C. Exploring diseases/traits and blood proteins causally related to expression of ACE2, the putative receptor of SARS-CoV-2: A Mendelian Randomization analysis highlights tentative relevance of diabetes related traits. medRxiv (2020) 43(7):1416–26. doi: 10.2337/dc20-0643
- Wenzhong L, Hualan L. COVID-19: Attacks the 1-Beta Chain of Hemoglobin and captures the porphyrin to inhibit human heme metabolism. (2020). doi: 10.26434/chemrxiv.11938173.v5.10
- de Wit E, van Doremalen N, Falzarano D, Munster VJ. SARS and MERS: recent insights into emerging coronaviruses. Nat Rev Microbiol (2016) 14 (8):523–34. doi: 10.1038/nrmicro.2016.81
- Danser AHJ, Epstein M, Batlle D. Renin-Angiotensin System Blockers and the COVID-19 Pandemic: At Present There Is No Evidence to Abandon ReninAngiotensin System Blockers. Hypertension (2020) 75(6):1382–5. doi: 10.1161/HYPERTENSIONAHA.120.15082
- Chen, N. et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 395, 507–513 (2020).
- Hadjadj, J. et al. Impaired type I interferon activity and inflammatory responses in severe COVID-19 patients. Science 369, 718–724 (2020)
- Bastard, P. et al. Auto-antibodies against type I IFNs in patients with life-threatening COVID-19. Science https://doi.org/10.1126/science.abd4585 (2020).
- Zeng, Z. et al. Longitudinal changes of inflammatory parameters and their correlation with disease severity and outcomes in patients with COVID-19 from Wuhan, China. Crit. Care 24, 525 (2020).
- Sestan, M. et al. Virus-induced interferon-γ causes insulin resistance in skeletal muscle and derails glycemic control in obesity. Immunity 49, 164–177. e6 (2018).
- Cariou, B. et al. Phenotypic characteristics and prognosis of inpatients with COVID-19 and diabetes: the CORONADO study. Diabetologia 63, 1500–1515 (2020).
- Lee, B. C. & Lee, J. Cellular and molecular players in adipose tissue inflammation in the development of obesity-induced insulin resistance. Biochim. Biophys. Acta 1842, 446–462 (2014).
- van Erp, E. A. et al. Natural killer cell activation by respiratory syncytial virus-specific antibodies is decreased in infants with severe respiratory infections and correlates with Fc-glycosylation. Clin. Transl. Immunol. 9, e1112 (2020)
- Kim, J. H. et al. Relationship between natural killer cell activity and glucose control in patients with type 2 diabetes and prediabetes. J. Diabetes Investig. 10, 1223–1228 (2019)
- Yang, J. K., Lin, S. S., Ji, X. J. & Guo, L. M. Binding of SARS coronavirus to its receptor damages islets and causes acute diabetes. Acta Diabetol. 47, 193–199 (2010).
- Bhatraju, P. K. et al. Covid-19 in critically ill patients in the Seattle region – case series. N. Engl. J. Med. 382, 2012–2022 (2020).
- Arentz, M. et al. Characteristics and outcomes of 21 critically ill patients with COVID-19 in Washington state. JAMA 323, 1612–1614 (2020).
- Tang, N., Li, D., Wang, X. & Sun, Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J. Thromb. Haemost. 18, 844–847 2020)
- The RECOVERY Collaborative Group. Dexamethasone in hospitalized patients with Covid-19 – preliminary report. N. Engl. J. Med. https://doi.org/10.1056/ NEJMoa2021436 (2020).
- Drucker, D. J. The biology of incretin hormones. Cell Metab. 3, 153–165 (2006)
- Willemen, M. J. et al. Use of dipeptidyl peptidase-4 inhibitors and the reporting of infections: a disproportionality analysis in the World Health Organization VigiBase. Diabetes Care 34, 369–374 (2011)
- Gorricho, J. et al. Use of oral antidiabetic agents and risk of community-acquired pneumonia: a nested casecontrol study. Br. J. Clin. Pharmacol. 83, 2034–2044 (2017).
- Li, Y. et al. The MERS-CoV receptor DPP4 as a candidate binding target of the SARS-CoV-2 spike. iScience 23, 101160 (2020).
- Raj, V. S. et al. Dipeptidyl peptidase 4 is a functional receptor for the emerging human coronavirus-EMC. Nature 495, 251–254 (2013).
- Varin, E. M. et al. Circulating levels of soluble dipeptidyl peptidase-4 are dissociated from inflammation and induced by enzymatic DPP4 inhibition. Cell Metab. 29, 320–334.e5 (2019).
- Romacho, T. et al. DPP4 deletion in adipose tissue improves hepatic insulin sensitivity in diet-induced obesity. Am. J. Physiol. Endocrinol. Metab. 318, E590–E599 (2020).
- Zhong, J., Maiseyeu, A., Davis, S. N. & Rajagopalan, S. DPP4 in cardiometabolic disease: recent insights from the laboratory and clinical trials of DPP4 inhibition. Circ. Res. 116, 1491–1504 (2015).
- Raj, V. S. et al. Adenosine deaminase acts as a natural antagonist for dipeptidyl peptidase 4-mediated entry of the Middle East respiratory syndrome coronavirus. J. Virol. 88, 1834–1838 (2014).
- Baggio, L. L. et al. Plasma levels of DPP4 activity and sDPP4 are dissociated from inflammation in mice and humans. Nat. Commun. 11, 3766 (2020).
- Dalan, R. et al. The association of hypertension and diabetes pharmacotherapy with COVID-19 severity and immune signatures: an observational study. Eur. Heart J. Cardiovasc. Pharmacother. https://.
- Solerte, S. et al. Sitagliptin treatment at the time of hospitalization was associated with reduced mortality in patients with type 2 diabetes and COVID-19: a multicenter case-control retrospective observational study. Diabetes Care https://doi.org/10.2337/.
- Noyan-Ashraf, M. H. et al. A glucagon-like peptide-1 analog reverses the molecular pathology and cardiac dysfunction of a mouse model of obesity. Circulation 127, 74–85 (2013).
- Fei, Y., Tang, N., Liu, H. & Cao, W. Coagulation dysfunction: a hallmark in COVID-19. Arch. Pathol. Lab. Med. 144, 1223–1229 (2020).
- Varga, Z. et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet 395, 1417–1418 (2020).
- Chung, W. S., Lin, C. L. & Kao, C. H. Diabetes increases the risk of deep-vein thrombosis and pulmonary embolism. A population-based cohort study. Thromb. Haemost. 114, 812–818 (2015).
- Zhao, Z. et al. Diabetes mellitus increases the incidence of deep vein thrombosis after total knee arthroplasty. Arch. Orthop. Trauma. Surg. 134, 79–83 (2014).
- Olesen, K. K. W. et al. Diabetes mellitus is associated with increased risk of ischemic stroke in patients with and without coronary artery disease. Stroke 50, 3347–3354 (2019).
- Hermine Muniangi-Muhitu, Elina Akalestou, Victoria Salem, Shivani Misra 3, Nicholas S. Oliver 3 and Guy A. Rutter 1,4*. Covid-19 and Diabetes: A Complex Bidirectional Relationship. Frontiers in Endocrinology | www.frontiersin.org 1 October 2020 | Volume 11 | Article 582936
 Hội Nội tiết & Đái tháo đường Việt Nam Hội Nội tiết & Đái tháo đường Việt Nam
Hội Nội tiết & Đái tháo đường Việt Nam Hội Nội tiết & Đái tháo đường Việt Nam